Taille et part du marché des essais cliniques
Analyse du marché des essais cliniques par Mordor Intelligence
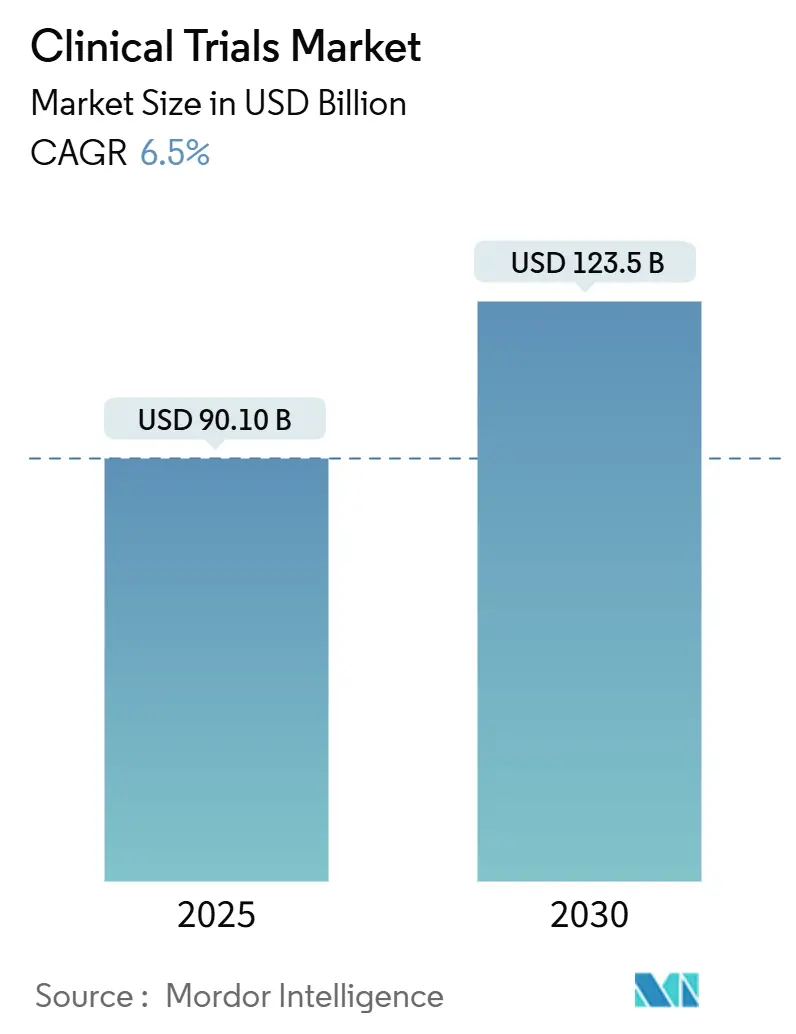
Le marché des essais cliniques devrait générer 90,1 milliards USD en 2025 et s'élargir à 123,5 milliards USD en 2030, se traduisant par un TCAC de 6,51 % entre 2025 et 2030. Les sponsors commerciaux pivotent vers des modèles d'exécution décentralisés ou hybrides pour contenir les dépenses liées aux sites, raccourcir les délais d'inscription et soutenir une surveillance en temps réel permise par des dispositifs connectés. L'adoption finale de la directive ICH E6(R3) de bonnes pratiques cliniques en janvier 2025 accélère ce changement en approuvant formellement la gestion de la qualité basée sur les risques, la collecte de données pragmatique et la surveillance à distance en priorité. L'oncologie conserve la plus grande part des démarrages de protocoles mondiaux, mais la neurologie, les maladies rares et les thérapies cellulaires et géniques se développent plus rapidement car elles bénéficient de conceptions adaptatives et d'un enrichissement de cohorte guidé par des biomarqueurs. Les organisations de recherche contractuelle (CRO) défendent leurs marges grâce aux investissements technologiques, tandis que les spécialistes émergents de taille moyenne grignotent les acteurs historiques de grande capitalisation en offrant une profondeur thérapeutique et une expertise réglementaire spécifique à la région. Les pénuries persistantes de personnel de site expérimenté et la complexité croissante des tests de biomarqueurs tempèrent la croissance, maintenant l'inflation des coûts au-dessus des normes historiques.
Principaux points à retenir du rapport
- Par phase, la Phase III tardive a commandé 55,0 % de la part de marché des essais cliniques en 2024, tandis que la Phase II devrait afficher un TCAC de 6,8 % jusqu'en 2030.
- Par conception d'étude, les études interventionnelles contrôlées randomisées ont sécurisé 72,3 % des revenus en 2024 ; les conceptions adaptatives devraient grimper à un TCAC de 8,2 % jusqu'en 2030.
- Par type de service, les activités de surveillance détenaient 28,5 % de la taille du marché des essais cliniques en 2024 ; les services décentralisés et virtuels devraient se développer à un TCAC de 14,6 %.
- Par domaine thérapeutique, l'oncologie représentait 29,7 % de la part de la taille du marché des essais cliniques en 2024, tandis que la neurologie est sur la voie d'un TCAC de 9,1 %.
- Par sponsor, les entreprises pharmaceutiques et biopharmaceutiques ont conservé 68,0 % de part de marché en 2024 ; le financement gouvernemental et à but non lucratif augmente à un TCAC de 7,5 %.
- Par géographie, l'Amérique du Nord représentait 49,2 % des revenus en 2024 ; l'Asie-Pacifique est la région à la croissance la plus rapide avec un TCAC de 7,9 %.
Tendances et insights du marché mondial des essais cliniques
Analyse de l'impact des moteurs
| Moteur | (~) % d'impact sur les prévisions TCAC | Pertinence géographique | Calendrier d'impact |
|---|---|---|---|
| Adoption d'essais décentralisés et hybrides | +1.9% | Mondial | Long terme (≥ 4 ans) |
| Expansion du pipeline de maladies rares et de médicaments orphelins | +1.6% | Amérique du Nord, UE, APAC | Long terme (≥ 4 ans) |
| Inclusion de sites Asie-Pacifique pour un recrutement plus rapide | +1.4% | Asie-Pacifique | Moyen terme (2-4 ans) |
| Solutions de recrutement de patients alimentées par l'IA | +1.8% | Mondial | Moyen terme (2-4 ans) |
| Incitations gouvernementales pour les essais d'oncologie | +2.2% | Mondial | Long terme (≥ 4 ans) |
| Utilisation croissante des preuves du monde réel (RWE) dans les études post-approbation | +1.8% | Mondial | Moyen terme (2-4 ans) |
| Source: Mordor Intelligence | |||
Adoption accélérée de plateformes d'essais décentralisés et hybrides
Les approches décentralisées permettent aux participants de compléter les visites par télésanté, laboratoires locaux et dispositifs à domicile, réduisant le fardeau des déplacements et augmentant la rétention. Le pool de revenus DCT mondial devrait atteindre 13,3 milliards USD d'ici 2030, soit un TCAC de 6,6 %. Quatre-vingt-dix pour cent des patients considèrent la participation DCT acceptable, soulignant une forte demande pour l'engagement à distance en priorité. Les directives finales de la FDA américaine sur les essais cliniques décentralisés, publiées en septembre 2024, confirment que les attentes réglementaires pour l'intégrité des données, le consentement éclairé et la surveillance de la sécurité restent identiques à celles des études basées sur les sites[1]U.S. Food and Drug Administration, "Conducting Clinical Trials With Decentralized Elements; Guidance for Industry, Investigators, and Other Interested Parties," federalregister.gov. Les sponsors font donc face à de nouvelles exigences opérationnelles concernant la qualification technologique, la surveillance basée sur les risques et la cybersécurité, qui façonnent déjà les critères de sélection des fournisseurs et stimulent l'investissement des CRO dans les plateformes numériques.
Augmentation des pipelines de maladies rares et de médicaments orphelins à l'échelle mondiale
La génomique et le séquençage de nouvelle génération ont illuminé les causes moléculaires de milliers de troubles précédemment idiopathiques, déclenchant une vague de programmes de thérapie ciblée. Bien qu'environ 30 millions de résidents américains vivent avec des maladies rares, seulement 500 conditions ont actuellement des traitements approuvés[2]National Institutes of Health, "Rare Diseases," nih.gov. Les incitations fiscales, les dispenses de frais d'utilisateur et l'exclusivité de sept ans sous la Loi américaine sur les médicaments orphelins continuent d'attirer le capital de risque et des grandes entreprises pharmaceutiques. Le programme de subventions FDA pour les thérapeutiques pour les maladies rares et négligées réduit davantage les risques des premières études humaines, conduisant à une forte croissance dans la collecte de cohortes d'histoire naturelle et les essais de preuve de concept stratifiés moléculairement. Le recrutement reste difficile car les populations de patients sont géographiquement dispersées et la latence diagnostique moyenne de cinq à sept ans, poussant les sponsors vers des stratégies d'inscription mondiales, multi-sites ou entièrement virtuelles.
Inclusion croissante de sites Asie-Pacifique pour optimiser les délais de recrutement
L'Asie-Pacifique représente maintenant plus de la moitié des nouveaux enregistrements d'essais cliniques, contre un tiers il y a seulement cinq ans[3]Novotech, "Evolution of Clinical Trials in the Asia Pacific Region Compared to the US and EU5," novotech-cro.com. L'accélération réglementaire de la Chine a réduit de moitié les délais d'examen et doublé les démarrages de protocoles entre 2017 et 2021, tandis que l'Inde, la Corée du Sud et le Japon offrent des voies spécialisées en oncologie et dispositifs. Le coût par patient inscrit est 30-40 % inférieur aux références occidentales, et les pools de population naïfs de traitement permettent un recrutement deux à trois fois plus rapide. Les régulateurs locaux acceptent de plus en plus les dossiers techniques communs et la surveillance basée sur les risques, mais l'hétérogénéité des langues, des statuts de confidentialité des données et des attentes des comités d'éthique complique les protocoles maîtres transfrontaliers. Les modèles hybrides qui associent des CRO domestiques et régionales atténuent ces défis, étendent la couverture des sites et facilitent l'utilisation de visites décentralisées qui s'adaptent aux préférences culturelles.
Solutions de recrutement de patients alimentées par l'IA améliorant l'efficacité d'inscription
Les algorithmes d'apprentissage automatique interrogent les dossiers de santé électroniques, les fichiers de réclamations et les bases de données génomiques pour identifier les participants potentiellement éligibles, augmenter les taux de réussite de pré-sélection et prédire le risque d'abandon. Depuis 2016, la FDA américaine a enregistré environ 300 soumissions mentionnant l'intelligence artificielle dans la conception de protocoles ou l'analyse de données. L'intégration de capteurs portables offre une surveillance de sécurité en temps réel, tandis que le traitement du langage naturel peut automatiser le triage des événements indésirables. L'adoption d'entreprise reste inégale car la transparence algorithmique, la validation de provenance des données et l'atténuation des biais nécessitent une gouvernance lourde, mais les premiers adoptants rapportent des réductions de temps de cycle à deux chiffres dans la faisabilité et le démarrage. La technologie soutient également les algorithmes de dosage adaptatif et la construction de bras de contrôle synthétiques, améliorant davantage l'efficacité statistique.
Analyse de l'impact des contraintes
| Contrainte | (~) % d'impact sur les prévisions TCAC | Pertinence géographique | Calendrier d'impact |
|---|---|---|---|
| Pénurie de coordinateurs de recherche clinique expérimentés | Non quantifié | Marchés émergents | Court terme (≤ 2 ans) |
| Complexité et coût croissants des conceptions adaptatives guidées par des biomarqueurs | Non quantifié | Mondial | Moyen terme (2-4 ans) |
| Surveillance accrue autour des lois de confidentialité des données (RGPD, CCPA) entravant le déploiement du e-consentement | Non quantifié | Amérique du Nord, UE | Moyen terme (2-4 ans) |
| Escalade liée à l'inflation des frais d'investigateur et de gestion de site en Europe occidentale | Non quantifié | Europe occidentale | Court terme (≤ 2 ans) |
| Source: Mordor Intelligence | |||
Pénuries persistantes de coordinateurs de recherche clinique expérimentés dans les marchés émergents
La croissance rapide des protocoles en Asie-Pacifique, Amérique latine et Europe de l'Est a dépassé l'offre de personnel de site compétent en ICH-GCP, collecte de données à distance et dossiers réglementaires complexes. Développer un coordinateur pleinement compétent prend deux à trois ans d'exposition encadrée, dépassant le taux de diplomation des nouveaux programmes de recherche clinique tels que le Master de recherche clinique accrédité CAAHEP offert par The Ohio State University. Les équipes inexpérimentées élèvent le risque de déviation de protocole, prolongent les visites de surveillance et sollicitent les budgets d'assurance qualité, érodant certains des avantages de coût qui motivaient initialement la délocalisation. Les sponsors répondent en regroupant les modules de formation du personnel dans les contrats de fournisseurs, en déployant des unités de surveillance mobile et en augmentant la surveillance statistique centrale, mais les lacunes de compétences restent un goulot d'étranglement aigu à court terme.
Complexité et coût croissants des conceptions adaptatives guidées par des biomarqueurs
L'enrichissement adaptatif, la randomisation adaptative à la réponse et les cadres Phase II/III sans couture adaptent l'allocation basée sur les lectures en temps réel, mais ils dépendent de tests validés, de flux de données continus et d'analyses bayésiennes sophistiquées. Un échantillon de biomarqueur mal classifié peut réduire la puissance de l'essai tout en gonflant l'erreur de type I, forçant des tailles d'échantillon plus importantes ou des amendements de protocole. Le coût direct par patient grimpe donc de 30-40 % au-dessus des ECR conventionnels appariés, et les régulateurs exigent des simulations détaillées de caractéristiques opérationnelles statistiques avant l'approbation des caractéristiques de conception. Malgré ces obstacles, les sponsors d'oncologie continuent d'embrasser les méthodes adaptatives, comme en témoigne le lancement en 2024 par ARPA-H de la plateforme ADAPT, qui utilise des retours génomiques et d'imagerie continus pour faire évoluer les cohortes pendant le recrutement actif.
Analyse de segment
Par phase : la dominance tardive masque l'innovation précoce
Les études de Phase III ont capturé 55,0 % du marché des essais cliniques en 2024 car elles impliquent de grandes cohortes multicentriques et des critères d'évaluation de qualité réglementaire qui commandent des budgets CRO premium. Un seul protocole d'oncologie de Phase III peut dépasser 40 000 USD par patient, les coûts de dépistage de biomarqueurs alimentant la croissance des dépenses. Néanmoins, les essais de Phase II se développeront plus rapidement à 6,8 % de TCAC car les conceptions adaptatives compriment les délais de preuve de concept et combinent la gamme de doses avec l'efficacité précoce. La région Asie-Pacifique héberge maintenant 58 % des démarrages globaux de Phase I grâce à la voie d'examen IND expédié de la Chine, renforçant l'accès précoce aux populations génétiquement diverses.
Les sponsors déploient des cadres Phase I/II sans couture pour accélérer les jalons go/no-go et encadrer l'investissement Phase III, une approche qui répartit les risques et optimise la priorisation des actifs. Les entreprises biotechnologiques soutenues par du capital-risque externalisent fréquemment ces études à des CRO de taille moyenne avec intégration de génomique de laboratoire, tandis que les grandes entreprises pharmaceutiques maintiennent des unités Phase I internes pour les modalités phares. Les agences réglementaires soutiennent l'innovation par des directives qui équilibrent la rigueur statistique avec la flexibilité, incitant les critères d'évaluation nouveaux et l'inclusion de biomarqueurs numériques. Ensemble, ces tendances renforcent un pipeline où les phases exploratoires deviennent plus riches en données même si les essais tardifs continuent d'absorber la majorité des dépenses dans le marché des essais cliniques.
Marché des essais cliniques : Part de marché par phase
| Phase III | 55.0% |
|---|---|
| Part combinée de Phase I, et plus | 45.0 |
| Source: Mordor Intelligence | |
Par conception d'étude : les approches adaptatives gagnent en élan
Les essais contrôlés randomisés interventionnels restent l'étalon-or réglementaire, absorbant 72,3 % des revenus en 2024 et ancrant les calculs de risque pour la plupart des thérapeutiques. La directive ICH E6(R3) approuve explicitement la surveillance proportionnée, encourageant les sponsors à intégrer des analyses intérimaires et des règles d'arrêt pré-spécifiées, alimentant ainsi un TCAC de 8,2 % pour les cadres adaptatifs. L'oncologie est à l'avant-garde : les structures parapluie, panier et plateforme testent plusieurs cohortes définies par des biomarqueurs en parallèle, tirant parti de bras de contrôle partagés pour réduire le fardeau d'inscription.
Le marché des essais cliniques intègre de plus en plus les essais de plateforme pour les maladies infectieuses, les troubles neurologiques et les conditions auto-immunes où l'hétérogénéité complique l'évaluation du traitement. Les packages de caractéristiques opérationnelles simulées accompagnent les soumissions réglementaires pour démontrer le contrôle du taux d'erreur, et la surveillance statistique centrale signale les anomalies de données plus rapidement que la vérification traditionnelle sur site. L'acceptation continue des constructions de protocole maître élargit l'utilisation de l'enrichissement adaptatif, renforçant la perception que la conception flexible n'est plus expérimentale mais une caractéristique essentielle de la génération de preuves moderne au sein du marché des essais cliniques.
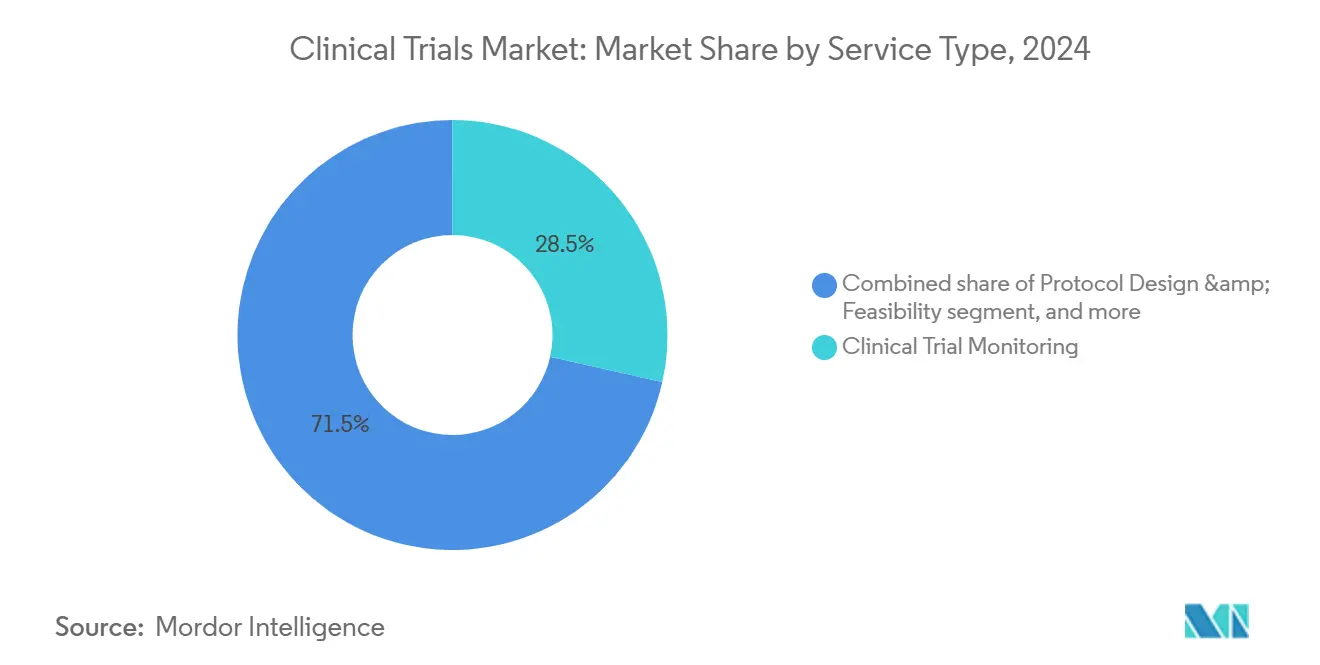
Par type de service : la surveillance domine tandis que les services virtuels augmentent
La surveillance représentait 28,5 % des revenus de 2024 car les sponsors priorisaient l'adhérence au protocole, la propreté des données et la protection des participants dans une ère de tests moléculaires complexes et de critères d'évaluation à coût élevé. Les systèmes de gestion de qualité basés sur les risques mandatés par ICH E6(R3) déplacent les budgets de la vérification exhaustive des données sources vers l'analyse centralisée qui se concentre sur les variables critiques. Pourtant, la surveillance sur site reste indispensable pour les interventions complexes nécessitant des vérifications de pharmacie de perfusion ou l'étalonnage d'imagerie.
Les lignes de service virtuel sont le composant à la croissance la plus rapide, suivant un TCAC de 14,6 %, car les dispositifs distants, le consentement éclairé électronique et les télé-visites s'étendent. Les modèles opérationnels décentralisés réduisent les barrières géographiques et élargissent l'inclusivité démographique, répondant aux mandats de diversité fixés par les régulateurs tels que les directives provisoires 2023 de la FDA américaine sur l'amélioration de l'inscription des populations sous-représentées. Les hôpitaux d'Asie-Pacifique s'associent de plus en plus avec des fournisseurs de technologie pour intégrer des évaluations virtuelles, donnant aux sponsors un écosystème qui fusionne des sites à faible coût avec une capture de données high-tech. Par conséquent, le marché des essais cliniques redéfinit la valeur grâce à des packages de services centrés sur les données et centrés sur les patients.
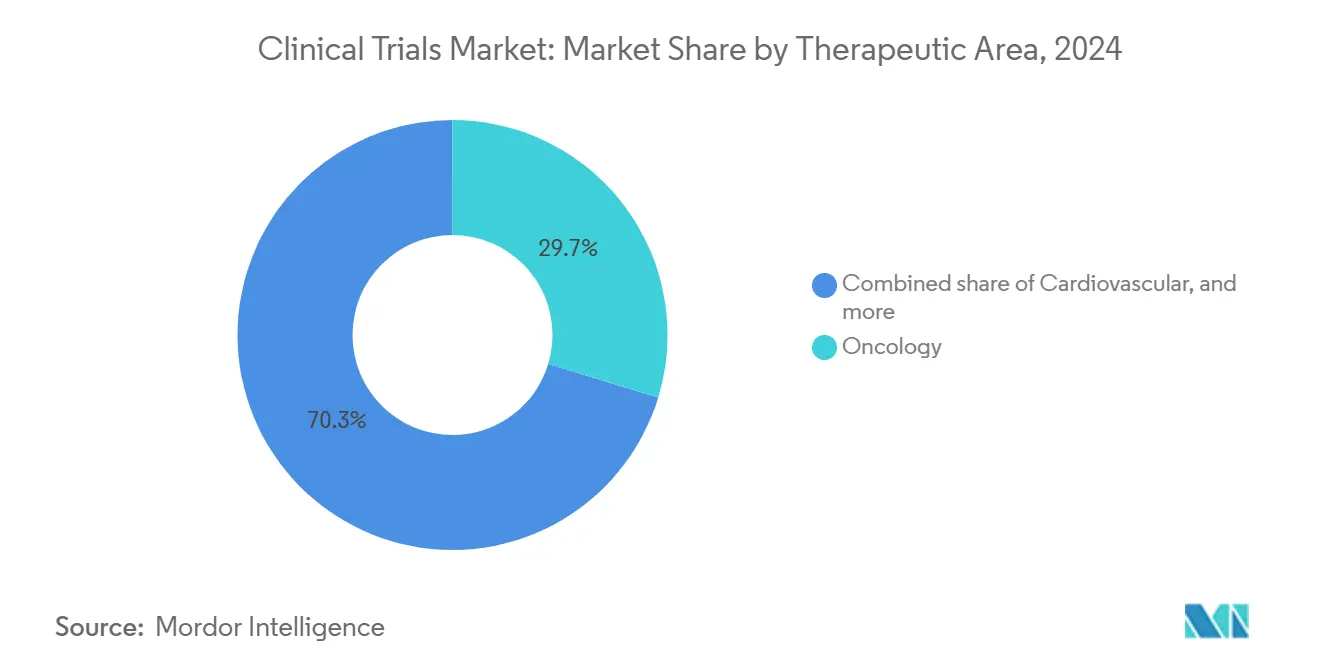
Par domaine thérapeutique : leadership en oncologie au milieu de la croissance neurologique
L'oncologie a stimulé 29,7 % des dépenses de 2024 car les besoins non satisfaits élevés, la réceptivité des payeurs à l'innovation et les complexités de biomarqueurs augmentent l'investissement en protocoles. Les essais de cancer financés par l'industrie dépassent les études soutenues par le gouvernement fédéral huit contre un, créant un environnement où la rapidité de mise sur le marché peut altérer les prévisions de franchise multi-milliardaires. La neurologie, propulsée par des percées dans l'imagerie amyloïde et tau plus les stratégies de silençage génique pour les maladies neuro-dégénératives rares, dépassera tous les domaines avec un TCAC de 9,1 % jusqu'en 2030.
Les programmes de maladies rares traversent l'oncologie et la neurologie, tirant parti des conceptions adaptatives pour gérer des cohortes ultra-petites et des comparateurs d'histoire naturelle. Les outils de segmentation pilotés par l'IA aident à prédire la progression de la maladie et adapter les fenêtres de critères d'évaluation, améliorant la puissance statistique sans gonfler la taille de l'échantillon. La montée des interventions basées sur les cellules et l'édition génique ajoute une complexité supplémentaire, poussant les sponsors à améliorer la validation des tests et la surveillance de sécurité longitudinale. De tels facteurs sous-tendent la réallocation continue du capital au sein du marché des essais cliniques vers des portefeuilles à haut risque biologique et haute récompense.
Par type de sponsor : les entreprises pharmaceutiques mènent tandis que le financement gouvernemental croît
Les entreprises pharmaceutiques et biopharmaceutiques représentaient 68 % de la valeur totale en 2024, s'engageant à plus de 30 milliards USD en paiements directs de sites et générant 62 milliards USD d'activité économique américaine. Le soutien de l'industrie a également financé plus de la moitié des essais les plus cités publiés dans des revues à comité de lecture depuis 2018, soulignant son influence dominante sur les agendas d'étude et les choix de conception.
Les organismes gouvernementaux, académiques et à but non lucratif développeront leur participation à un TCAC de 7,5 %, ciblant les priorités de santé publique telles que la résistance antimicrobienne, la préparation aux pandémies et les troubles pédiatriques rares. Les partenariats public-privé fusionnent l'insight de science fondamentale avec le muscle de développement commercial, réduisant les risques des modalités frontière comme les vaccins ARNm et les thérapeutiques CRISPR. La diversification du financement ajoute de la résilience au marché des essais cliniques et aide à se protéger contre les chocs spécifiques au secteur, tout en élevant les attentes de transparence et les mandats de partage de données.
Analyse géographique
L'Amérique du Nord a généré 49,2 % des revenus mondiaux en 2024, soutenue par un écosystème réglementaire mature, des réseaux d'investigateurs avancés et un capital scientifique abondant. Les multiplicateurs économiques au niveau des États soulignent la valeur locale des dépenses d'essais : la Floride a capturé 8,3 milliards USD, le Texas 7,7 milliards USD et la Californie 7,1 milliards USD d'activité en 2024. Les autorités régionales priorisent de plus en plus l'innovation méthodologique sur le volume pur, comme en témoignent les directives d'agence sur les essais décentralisés, les conceptions adaptatives et l'intégration de preuves du monde réel. Le marché des essais cliniques ici fait face à la pression des coûts, poussant les sponsors vers des modèles hybrides qui conservent des hubs américains stratégiques tout en délocalisant les procédures de moindre intensité.
L'Asie-Pacifique devrait croître à un TCAC de 7,9 %, remodelant le marché mondial des essais cliniques grâce à la libéralisation réglementaire, l'accélération des délais d'examen et de grandes populations naïves de traitement. La Chine et l'Inde représentent ensemble près de 40 % des protocoles actifs totaux. Le cadre IRB centralisé de la Corée du Sud, la voie d'approbation conditionnelle du Japon pour la médecine régénérative, et le sandbox d'intégrité des données de Taïwan pour la vérification e-source basée sur la blockchain établissent collectivement des niches différenciées. La structure de coûts de la région - 30-40 % moins chère par patient - et la vitesse de recrutement - deux à trois fois plus rapide que les références occidentales - créent une proposition convaincante. Cependant, la variation des statuts de confidentialité des données et la maîtrise de l'anglais posent des défis de protocole maître transfrontalier, incitant les alliances CRO qui mélangent le savoir-faire régional avec la standardisation de processus mondial.
L'Europe conserve une expertise scientifique considérable et une infrastructure spécialisée, mais sa part relative du marché des essais cliniques a diminué au milieu des délais de démarrage prolongés et de l'inflation des coûts. Le Règlement sur les essais cliniques (CTR) vise à rationaliser les autorisations multi-États membres grâce à un portail centralisé, tandis que l'Agence européenne des médicaments met l'accent sur la mesure des résultats centrés sur le patient[4]European Medicines Agency, "Clinical trial," ema.europa.eu. Le Brexit introduit une couche supplémentaire de complexité : les sponsors britanniques doivent naviguer des pistes de conformité duales, bien que le nouveau cadre de Windsor facilite le flux de données pour l'Irlande du Nord. La croissance future se concentrera probablement sur les maladies rares, les médicaments de thérapie avancée et les méthodes statistiques complexes où les réseaux académiques européens conservent une force compétitive.
Paysage concurrentiel
Le marché des essais cliniques démontre une concentration modérée : les cinq plus grandes CRO - IQVIA, Labcorp, ICON, Parexel et Syneos - détenaient collectivement environ 40 % des revenus en 2024. IQVIA tire parti de sa plateforme mondiale de science des données pour mener plus de 500 essais décentralisés ou hybrides dans 75 pays et 30 indications, atteignant la validation de conformité RGPD pour sa pile technologique. Labcorp a complété la scission de son bras de développement clinique en 2023, aiguisant le focus stratégique sur les services de laboratoire et de test central tandis que l'entité nouvellement indépendante poursuit l'expansion CRO. L'acquisition de 12 milliards USD d'ICON de PRA Health Sciences a consolidé les empreintes thérapeutiques et géographiques, élevant ICON au troisième plus grand CRO mondial.
Les CRO de niveau intermédiaire exploitent la spécialisation thérapeutique - telle que la thérapie cellulaire, l'ophtalmologie ou l'intégration de santé numérique - pour gagner des protocoles de sponsors recherchant une expertise sur mesure. Les CRO régionales en Chine, Inde et Asie du Sud-Est s'associent avec des entreprises multinationales pour naviguer les approbations d'éthique locales, la localisation linguistique et les exigences de surveillance post-marché. Les partenariats technologiques avec les fournisseurs de consentement électronique, les plateformes d'agrégation de données et les fabricants de portables différencient les offres et soutiennent la gestion de qualité basée sur les risques. La concurrence s'intensifie également autour de la faisabilité alimentée par l'IA, avec des fournisseurs offrant des modèles d'inscription prédictifs qui réduisent le temps de sélection de site.
Les opportunités d'espace blanc se concentrent dans les maladies rares, les biologiques complexes et la livraison de service décentralisé. Les sponsors valorisent les fournisseurs qui peuvent intégrer l'accès patient distant, la phlébotomie à domicile et la télémétrie de dispositif sous des cadres de qualité conformes. Les CRO investissent activement dans les capacités de cybersécurité pour protéger les données patients - surtout en Europe où les amendes RGPD dépassent 4 % du chiffre d'affaires mondial, et aux États-Unis où une proposition bipartite 2025 cherche à harmoniser les normes nationales de confidentialité. Ces dynamiques garantissent que l'avantage concurrentiel au sein du marché des essais cliniques dépendra de plus en plus de la maturité technologique, du focus thérapeutique et de la maîtrise réglementaire plutôt que de l'échelle seule.
Leaders de l'industrie des essais cliniques
-
IQVIA Holdings Inc.
-
Laboratory Corporation of America (Labcorp)
-
ICON plc
-
Parexel International Corp.
-
Syneos Health
- *Avis de non-responsabilité : les principaux acteurs sont triés sans ordre particulier
Développements récents de l'industrie
- Février 2025 : ICON plc a publié une analyse approfondie d'ICH E6(R3), mettant l'accent sur le rôle de la technologie dans l'évaluation des risques en temps réel.
- Janvier 2025 : ICH a finalisé la directive primaire E6(R3), initiant la première refonte holistique de GCP en 27 ans.
- Décembre 2024 : La FDA a publié un projet de directive sur ICH E6(R3) Annexe 2, renforçant les principes de conception décentralisés et pragmatiques.
- Novembre 2024 : La FDA a finalisé les directives sur les essais décentralisés, clarifiant les attentes pour l'intégrité des données distantes et la sécurité des participants.
- Novembre 2024 : ICH a publié l'Annexe 2 finale E6(R3) de bonnes pratiques cliniques, détaillant les directives d'implémentation pour la gestion de qualité basée sur les risques.
- Septembre 2024 : La FDA a publié un projet de directive sur les essais d'oncologie multirégionaux, abordant les proportions d'inscription américaines en déclin.
- Mars 2024 : ARPA-H a lancé le programme ADAPT pour pionnier les conceptions d'essai d'oncologie évolutionnaires ancrées dans les données granulaires de patients.
Portée du rapport mondial sur le marché des essais cliniques
Selon la portée du rapport, les essais cliniques sont des expériences qui sont menées sous la recherche clinique et suivent un protocole réglementé. Ces essais sont principalement effectués pour obtenir des données concernant la sécurité et l'efficacité de médicaments nouvellement développés. Les données d'essais cliniques sont obligatoires pour l'approbation de médicaments et pour qu'ils soient introduits sur le marché. Ce processus est coûteux et chronophage et nécessite une expertise à toutes les étapes.
Le secteur des essais cliniques est segmenté par phase, conception et géographie. Basé sur la phase, le marché est segmenté en phase I, phase II, phase III et phase IV. Basé sur la conception, le marché est segmenté en études de traitement et études observationnelles. Basé sur la géographie, le marché est segmenté en Amérique du Nord, Europe, Asie-Pacifique, Moyen-Orient et Afrique, et Amérique du Sud. Le PDF du rapport couvre également la taille de marché estimée et les tendances pour 17 pays dans les principales régions globalement. Le PDF du rapport de marché offre des valeurs (USD) pour tous les segments ci-dessus.
| Phase I |
| Phase II |
| Phase III |
| Phase IV |
| Études interventionnelles / de traitement |
| Études observationnelles |
| Études d'accès élargi |
| Conception de protocole et faisabilité |
| Identification de site et démarrage |
| Soumission et approbation réglementaires |
| Surveillance d'essais cliniques |
| Gestion de données et biostatistiques |
| Rédaction médicale |
| Autres types de services |
| Oncologie |
| Cardiovasculaire |
| Neurologie |
| Maladies infectieuses |
| Troubles métaboliques (diabète, obésité) |
| Immunologie / auto-immune |
| Autres domaines thérapeutiques |
| Entreprises pharmaceutiques et biopharmaceutiques |
| Entreprises de dispositifs médicaux |
| Instituts académiques et de recherche |
| Organisations gouvernementales et à but non lucratif |
| Amérique du Nord | États-Unis |
| Canada | |
| Mexique | |
| Europe | Allemagne |
| Royaume-Uni | |
| France | |
| Italie | |
| Espagne | |
| Reste de l'Europe | |
| Asie-Pacifique | Chine |
| Japon | |
| Inde | |
| Corée du Sud | |
| Australie | |
| Reste de l'Asie-Pacifique | |
| Moyen-Orient et Afrique | CCG |
| Afrique du Sud | |
| Reste du Moyen-Orient et de l'Afrique | |
| Amérique du Sud | Brésil |
| Argentine | |
| Reste de l'Amérique du Sud |
| Par phase | Phase I | |
| Phase II | ||
| Phase III | ||
| Phase IV | ||
| Par conception d'étude | Études interventionnelles / de traitement | |
| Études observationnelles | ||
| Études d'accès élargi | ||
| Par type de service | Conception de protocole et faisabilité | |
| Identification de site et démarrage | ||
| Soumission et approbation réglementaires | ||
| Surveillance d'essais cliniques | ||
| Gestion de données et biostatistiques | ||
| Rédaction médicale | ||
| Autres types de services | ||
| Par domaine thérapeutique | Oncologie | |
| Cardiovasculaire | ||
| Neurologie | ||
| Maladies infectieuses | ||
| Troubles métaboliques (diabète, obésité) | ||
| Immunologie / auto-immune | ||
| Autres domaines thérapeutiques | ||
| Par type de sponsor | Entreprises pharmaceutiques et biopharmaceutiques | |
| Entreprises de dispositifs médicaux | ||
| Instituts académiques et de recherche | ||
| Organisations gouvernementales et à but non lucratif | ||
| Géographie | Amérique du Nord | États-Unis |
| Canada | ||
| Mexique | ||
| Europe | Allemagne | |
| Royaume-Uni | ||
| France | ||
| Italie | ||
| Espagne | ||
| Reste de l'Europe | ||
| Asie-Pacifique | Chine | |
| Japon | ||
| Inde | ||
| Corée du Sud | ||
| Australie | ||
| Reste de l'Asie-Pacifique | ||
| Moyen-Orient et Afrique | CCG | |
| Afrique du Sud | ||
| Reste du Moyen-Orient et de l'Afrique | ||
| Amérique du Sud | Brésil | |
| Argentine | ||
| Reste de l'Amérique du Sud | ||
Questions clés répondues dans le rapport
ABCQuelle est la valeur actuelle du marché des essais cliniques et à quelle vitesse croît-il ?
Le marché des essais cliniques devrait générer 90,1 milliards USD en 2025 et atteindre 123,5 milliards USD d'ici 2030, reflétant un TCAC de 6,5 %.
Quelle phase d'essai attire les dépenses les plus élevées ?
La Phase III commande 55 % des dépenses totales car elle implique de grandes cohortes multi-régionales et des critères d'évaluation de qualité réglementaire qui entraînent des coûts élevés par patient.
Pourquoi les essais cliniques décentralisés sont-ils importants pour les sponsors ?
Les conceptions décentralisées ou hybrides réduisent les déplacements des patients, améliorent la rétention et permettent une surveillance distante en temps réel, soutenant un recrutement plus rapide et des délais potentiellement plus courts.
Qu'est-ce qui rend l'Asie-Pacifique attractive pour le développement clinique ?
Les essais en Asie-Pacifique peuvent être 30-40 % moins chers par patient et recruter deux à trois fois plus rapidement que les emplacements occidentaux grâce aux grandes populations naïves de traitement et aux cadres réglementaires rationalisés.
Quelle est l'ampleur de l'opportunité dans la recherche sur les maladies rares ?
Avec seulement 500 traitements approuvés pour 7 000 conditions rares identifiées, les programmes de maladies rares représentent une arène de croissance considérable, stimulée par les crédits d'impôt et les incitations d'exclusivité de marché.
Qui sont les CRO leaders sur le marché actuel ?
IQVIA et Labcorp mènent, suivis par ICON, Parexel et Syneos ; ensemble ils détiennent environ 40 % des revenus CRO mondiaux.
Dernière mise à jour de la page le: