Taille et part du marché mondial des services de purification virale
Analyse du marché mondial des services de purification virale par Mordor Intelligence
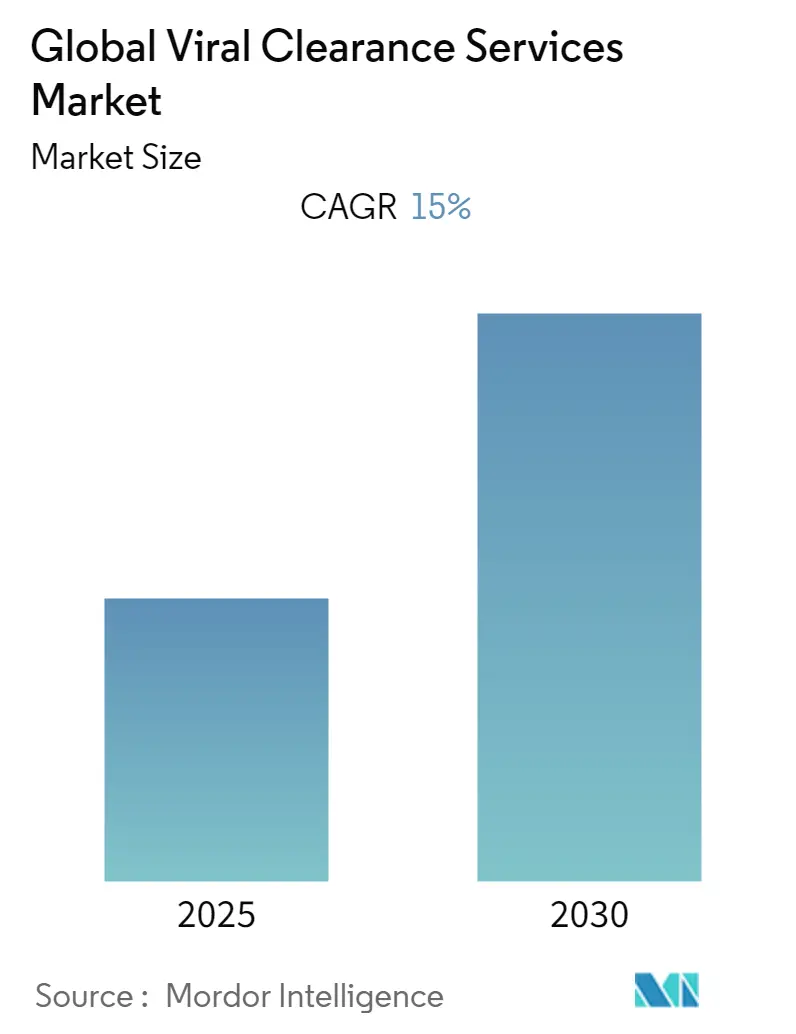
La taille du marché des services de purification virale s'élevait à 0,96 milliard USD en 2025 et devrait atteindre 1,93 milliard USD d'ici 2030, progressant à un TCAC de 15,02 %. Cette trajectoire de doublement reflète la demande croissante de validation de sécurité virale dans les produits biologiques, vaccins et modalités avancées telles que les thérapies cellulaires et géniques. La validation basée sur des plateformes encouragée par la mise à jour Q5A(R2) de la Food and Drug Administration (FDA) des États-Unis un raccourci les délais d'études, transformant la purification virale d'une case à cocher de conformité en un catalyseur stratégique de lancements de produits plus rapides fda.gov. L'expansion rapide des pipelines de vecteurs virus adéno-associés (AAV) et lentiviraux un encore amplifié le besoin de protocoles sur mesure, tandis que l'externalisation vers des organisations spécialisées de développement et de fabrication sous contrat (CDMO) accélère la croissance des capacités.
Les catalyseurs de croissance clés incluent la renaissance mondiale de la fabrication de grosses molécules, les cadres réglementaires harmonisés sur les principaux marchés, et l'industrialisation constante du biotraitement en continu. La dynamique concurrentielle se remodèle alors que les fournisseurs d'équipements traditionnels étendent leurs activités aux services et que les organisations de recherche sous contrat (CRO) spécialisées acquièrent des actifs de fabrication pour fournir des offres de bout en bout. Malgré des perspectives robustes, les études multi-virus coûteuses, les pénuries de personnel qualifié en biosécurité, et les orientations fragmentées pour les nouvelles modalités posent des obstacles.
Points clés du rapport
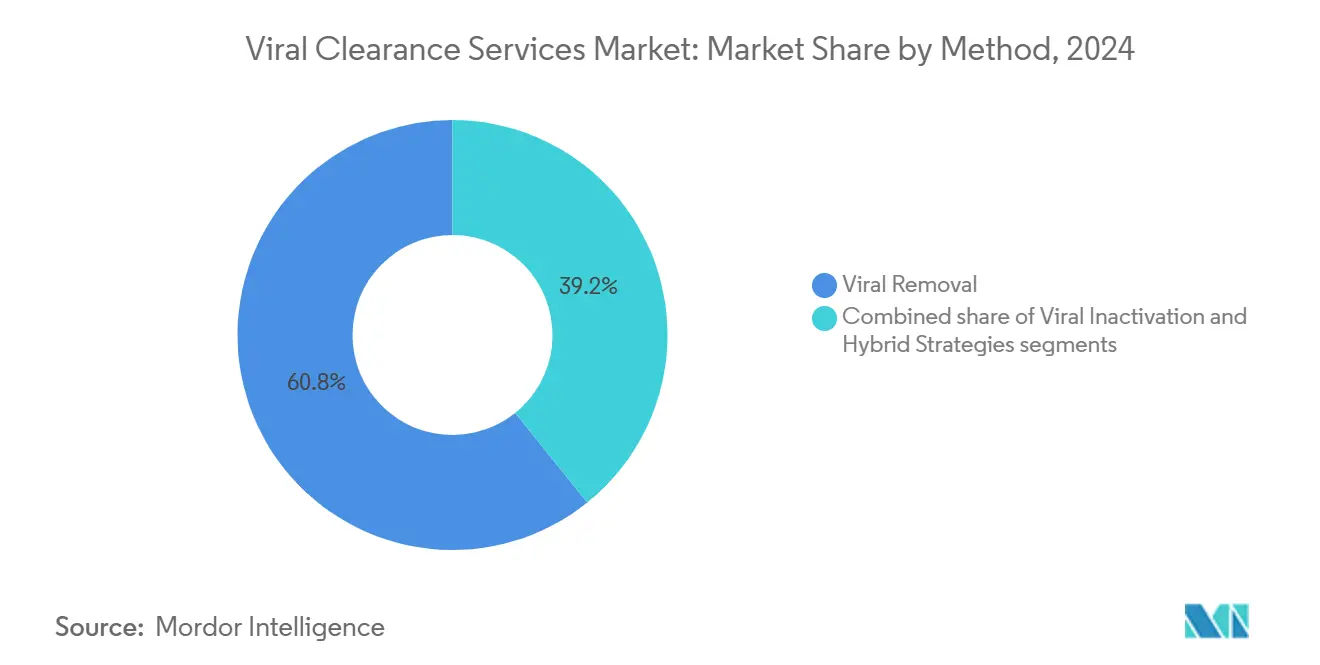
- Par méthodologie, les techniques d'élimination virale détenaient une part de 60,78 % du marché des services de purification virale en 2024, tandis que les stratégies hybrides sont projetées pour croître à un TCAC de 17,04 % jusqu'en 2030.
- Par application, les protéines recombinantes menaient avec 43,59 % de part de revenus en 2024 ; les thérapies géniques et cellulaires sont prévues pour s'étendre à un TCAC de 18,16 % jusqu'en 2030.
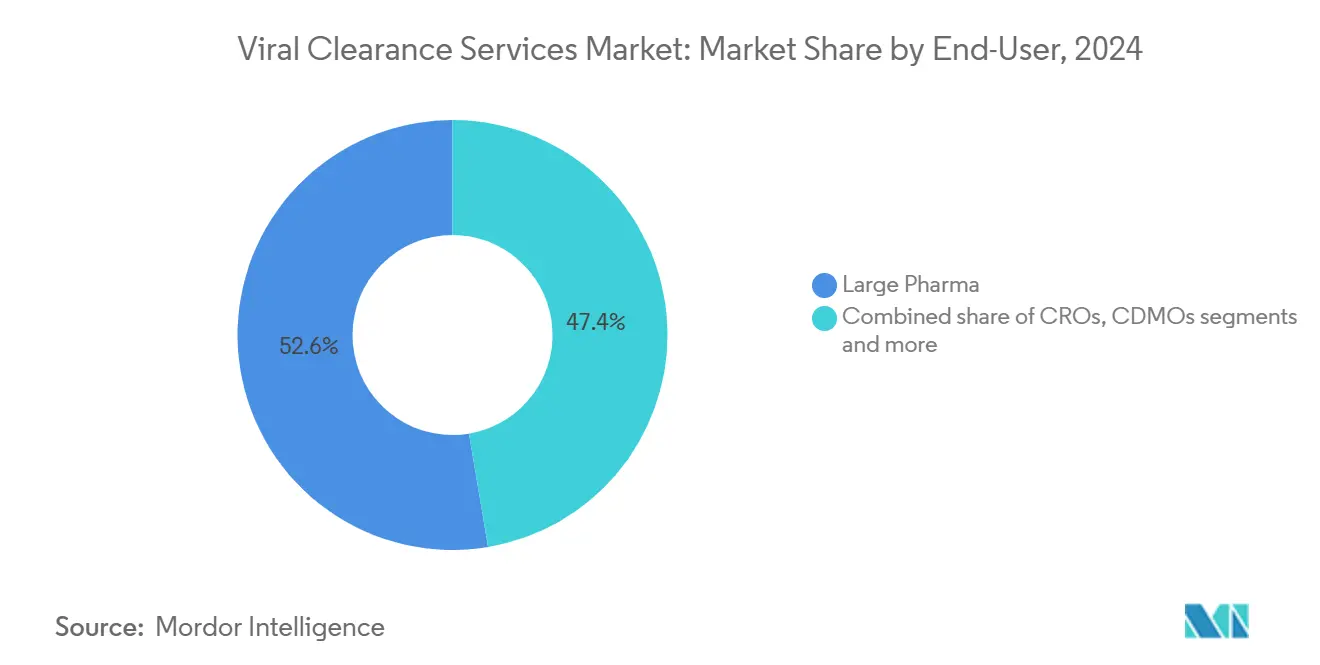
- Par utilisateur final, les grandes entreprises pharmaceutiques représentaient 52,64 % de la part du marché des services de purification virale en 2024, mais les CDMO enregistrent le TCAC projeté le plus rapide à 16,89 % jusqu'en 2030.
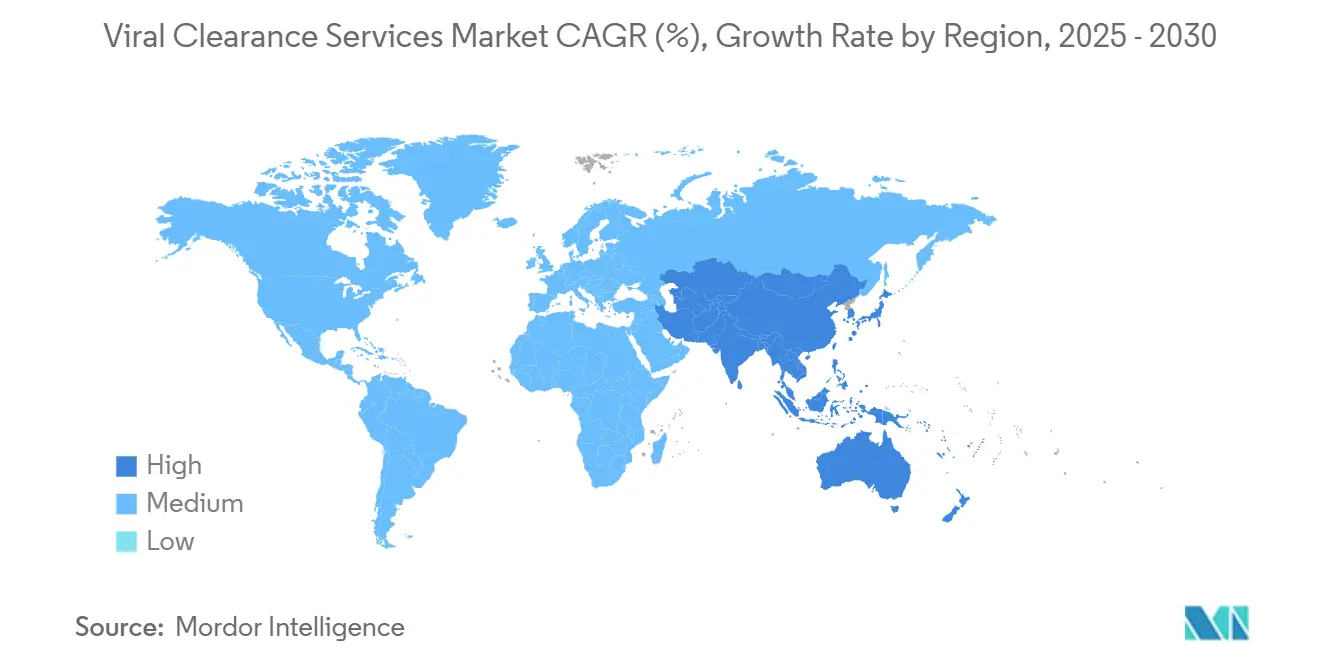
- Par géographie, l'Amérique du Nord commandait 39,32 % de la taille du marché des services de purification virale en 2024, tandis que l'Asie-Pacifique progresse à un TCAC de 16,47 % jusqu'en 2030.
Tendances et perspectives du marché mondial des services de purification virale
Analyse d'impact des moteurs
| Moteur | Impact (%) sur les prévisions TCAC | Pertinence géographique | Chronologie d'impact |
|---|---|---|---|
| Demande croissante de validation de sécurité virale dans la fabrication de grosses molécules | +3.2% | Mondiale, avec concentration en Amérique du Nord et UE | Moyen terme (2-4 ans) |
| Expansion mondiale du pipeline de produits biologiques et biosimilaires | +2.8% | Mondiale, avec accélération des marchés émergents en APAC | Long terme (≥ 4 ans) |
| Boom des thérapies cellulaires et géniques nécessitant des protocoles sur mesure | +2.7% | Mondiale, avec leadership réglementaire aux États-Unis et UE | Long terme (≥ 4 ans) |
| Poussée d'externalisation vers les CRO/CDMO spécialisées | +2.1% | Cœur Amérique du Nord et UE, débordement vers APAC | Court terme (≤ 2 ans) |
| Le biotraitement en continu stimule les technologies de purification en ligne | +1.9% | Amérique du Nord et UE, adoption précoce dans certains marchés APAC | Moyen terme (2-4 ans) |
| Les plateformes de validation prédictive basées sur l'IA raccourcissent les délais d'études | +1.5% | Amérique du Nord et UE, adoption graduelle APAC | Moyen terme (2-4 ans) |
| Source: Mordor Intelligence | |||
Demande croissante de validation de sécurité virale dans la fabrication de grosses molécules
La production de grosses molécules un déplacé la purification virale en amont dans la conception des procédés. Les orientations FDA[1]Food and Drug Administration, "Q5A(R2) Viral Safety Evaluation of Biotechnology Products," fda.gov récompensent désormais les approches de plateforme, permettant aux fabricants de réutiliser les données de purification dans les programmes d'anticorps monoclonaux tout en préservant la sécurité. Les lignes de biotraitement en continu intègrent des filtres à virus en ligne qui fournissent une assurance en temps réel, améliorant les rendements et réduisant les coûts de revalidation. Les entreprises dotées de telles capacités intégrées lancent leurs produits plus tôt et limitent les questions réglementaires, transformant la capacité de purification virale en un avantage concurrentiel clair. Les innovateurs d'équipements ont répondu avec des filtres à flux élevé qui protègent la qualité du produit sans compromettre le débit.
Expansion mondiale du pipeline de produits biologiques et biosimilaires
Plus de 700 thérapies géniques et des centaines de biosimilaires sont en développement, et chaque nouveau entrant nécessite une purification rigoureuse. Les efforts du Conseil international d'harmonisation (ICH) ont standardisé les exigences de sorte qu'un seul paquet de validation peut soutenir les soumissions sur plusieurs continents. Les fournisseurs de services capturent donc une part plus importante des budgets de développement. Eurofins Scientific, par exemple, un rapporté un rebond dans les grandes études contractuelles et alloué une capacité supplémentaire[2]Eurofins Scientific, "9M 2024 Trading Update," cdnmedia.eurofins.com au travail de sécurité virale.
Boom des thérapies cellulaires et géniques nécessitant des protocoles sur mesure
Les plateformes AAV, lentivirales et oncolytiques exigent des protocoles ajustés à la taille du vecteur, à la structure de l'enveloppe et au tropisme tissulaire. L'approbation par la FDA de thérapies comme BEQVEZ pour l'hémophilie B souligne la voie réglementaire qui mûrit, pourtant chaque nouveau sérotype de vecteur peut déclencher de nouvelles questions de sécurité. Lonza et Charles River commercialisent maintenant des Panneaux de purification spécifiques aux vecteurs qui réduisent le temps de développement de plusieurs semaines tout en maintenant la conformité mondiale. Ces services sur mesure positionnent les fournisseurs pour capturer une tarification premium alors que la vague de thérapie génique prend de l'ampleur.
Poussée d'externalisation vers les CRO/CDMO spécialisées
Les entreprises biopharmaceutiques considèrent de plus en plus les suites de purification virale internes comme non essentielles, optant plutôt pour les CDMO qui mènent des centaines d'études annuellement. Ce modèle offre des économies d'échelle, donne aux petites entreprises de biotechnologie un accès instantané à des virologues expérimentés, et protège les grandes entreprises contre les poussées soudaines de projets. L'acquisition de Mirus Bio par Merck pour 600 millions USD et l'achat de Vigene Biosciences par Charles River pour 292,5 millions USD illustrent l'intégration verticale qui façonne le marché des services de purification virale.
Analyse d'impact des contraintes
| Contrainte | Impact % sur les prévisions TCAC | Pertinence géographique | Chronologie d'impact |
|---|---|---|---|
| Coût élevé et complexité des études de validation multi-virus | -2.4% | Mondiale, avec impact aigu dans les marchés émergents | Court terme (≤ 2 ans) |
| Pénurie de main-d'œuvre qualifiée en virologie et biosécurité | -1.8% | Principalement Amérique du Nord et UE, émergent en APAC | Moyen terme (2-4 ans) |
| Orientations mondiales fragmentées pour les nouvelles modalités (ex. AAV) | -1.2% | Mondiale, avec lacunes de leadership réglementaire dans les marchés émergents | Long terme (≥ 4 ans) |
| Lacunes de chaîne d'approvisionnement en virus modèles qualifiés et standards de référence | -0.9% | Mondiale, avec risques de concentration chez les fournisseurs spécialisés | Court terme (≤ 2 ans) |
| Source: Mordor Intelligence | |||
Coût élevé et complexité des études de validation multi-virus
Les études complètes impliquent souvent trois à cinq virus modèles, chacun testé sur plusieurs étapes de procédé. Les dépenses de recherche totales vont de 500 000 à 2 millions USD, sollicitant les budgets des petites biotechs et dissuadant les innovateurs dans les régions aux ressources limitées. Les chaînes d'approvisionnement de réactifs sont fragiles, avec de longs délais pour les stocks de semences qualifiés. Les fournisseurs de services contrent les coûts en adoptant des substituts non infectieux et des validations de plateforme riches en données que les régulateurs acceptent maintenant.
Pénurie de main-d'œuvre qualifiée en virologie et biosécurité
La demande de virologues expérimentés un dépassé l'offre de 42 % depuis 2018, selon les analyses sectorielles. Les retraites dans le système de laboratoires de santé publique exacerbent l'écart, tandis que les pipelines académiques peinent à suivre le rythme. Les entreprises automatisent les essais de routine et s'associent avec les universités sur des programmes de certification accélérée, pourtant la pénurie de talents continue de limiter les ajouts de capacité mondiale.
Analyse des segments
Par méthode : Les stratégies hybrides stimulent l'innovation
Les méthodes d'élimination virale ont capturé 60,78 % de la taille du marché des services de purification virale en 2024, réaffirmant leur statut de colonne vertébrale de la sécurité des bioprocédés. La chromatographie, la filtration en profondeur et les membranes de rétention virale offrent des valeurs de réduction logarithmique prévisibles pour les anticorps monoclonaux et les protéines recombinantes. Les trains aval en continu tissent maintenant ces étapes dans des systèmes fermés à usage unique qui maintiennent la stérilité tout en minimisant les temps de rétention.
Les stratégies hybrides, bien que représentant une base plus petite, croissent à un TCAC de 17,04 % jusqu'en 2030 et remodèlent les portefeuilles de services. Les fournisseurs intègrent l'inactivation solvant/détergent, la rétention à pH bas et l'irradiation UV-C avec l'élimination physique dans des séquences délibérées qui s'attaquent aux menaces enveloppées et non enveloppées. Le filtre Planova FG1 d'Asahi Kasei[3]Asahi Kasei Medical, "Planova FG1 Product Release," asahi-kasei.com démontre comment les membranes à flux élevé accélèrent le débit sans sacrifier les facteurs de réduction logarithmique des virus. La taille du marché des services de purification virale pour les protocoles hybrides est projetée pour s'étendre de 140 millions USD en 2025 à 350 millions USD en 2030, soulignant l'appétit de l'industrie pour la résilience multimodale.
Les hybrides de deuxième génération superposent le traitement haute pression ou la nanofiltration aux étapes héritées pour combattre les parvovirus robustes. Les outils de conception guidés par IA suggèrent des combinaisons d'étapes optimales, réduisant les essais expérimentaux jusqu'à 30 %. Ces innovations améliorent la prévisibilité et soutiennent la poussée des régulateurs vers des cadres de validation basés sur le risque et guidés par la science. Alors que la fabrication continue gagne du terrain, les fournisseurs capables d'intégrer des modules hybrides en ligne gagneront des parts au détriment des concurrents orientés lots.
Note: Parts de segments de tous les segments individuels disponibles à l'achat du rapport
Par application : Les thérapies géniques remodèlent les paradigmes de validation
Les protéines recombinantes détenaient 43,59 % de la part du marché des services de purification virale en 2024, bénéficiant d'études de plateforme standardisées qui couvrent plusieurs variantes d'anticorps. L'efficacité du segment provient de trains partagés de capture, de polissage et de réduction virale qui réduisent les coûts marginaux par molécule.
Les thérapies géniques et cellulaires, cependant, s'étendent à un TCAC de 18,16 % et atteindront environ 30 % de la taille globale du marché des services de purification virale d'ici 2030. La fabrication AAV passe des systèmes adhérents aux systèmes de suspension, atteignant 85-95 % de récupération de vecteur[4]Kai Chen, "Advanced Biomanufacturing and Evaluation of Adeno-Associated Virus," Journal of Biological Engineering, jbioleng.biomedcentral.com tout en imposant une élimination stricte des particules compétentes pour la réplication. Chaque nouveau sérotype peut nécessiter de nouvelles données de purification, limitant les économies d'échelle mais stimulant la demande de services premium. Les fournisseurs offrent des Panneaux de contamination virale spécifiques aux vecteurs et des essais AAV compétents pour la réplication afin de satisfaire les régulateurs aux États-Unis et dans l'Union européenne.
Les anticorps monoclonaux continuent une demande stable alors que les formats de nouvelle génération tels que les bispécifiques entrent en phases cliniques, pourtant les attentes de purification restent familières, facilitant les charges de travail des fournisseurs. Les produits dérivés de tissus et de sang nécessitent des méthodes d'inactivation orthogonales pour contrer les virus endogènes. Les fabricants de vaccins cherchent l'équilibre entre l'intégrité antigénique et l'inactivation des pathogènes, s'appuyant sur des étapes solvant/détergent ou UV-C combinées à la filtration.
Par utilisateur final : Les CDMO capturent la vague d'externalisation
Les grandes entreprises pharmaceutiques représentaient 52,64 % de la part du marché des services de purification virale en 2024, tirant parti des laboratoires de biosécurité internes aux côtés de l'externalisation sélective pour la capacité de pointe. Les capacités internes garantissent que le savoir-faire de procédé propriétaire reste confidentiel tout en préservant la flexibilité de planification pour les programmes de stade avancé.
Les CDMO, bien que plus petites aujourd'hui, dépassent tous les autres segments à 16,89 % TCAC. Les accords massifs tels que l'achat du site Vacaville de Roche par Lonza pour 1,2 milliard USD ont ajouté du volume de réacteur et des suites de biosécurité prêtes pour le travail externalisé. La taille du marché des services de purification virale attribuable aux CDMO est prévue pour croître de 270 millions USD en 2025 à 590 millions USD en 2030. Les petites et moyennes entreprises de biotechnologie gravitent vers les CDMO pour éviter les laboratoires BSL-2/3 intensifs en capital et pour exploiter les virologues vétérans qui peuvent naviguer dans plusieurs juridictions réglementaires. Les CRO avec des portefeuilles d'essais spécialisés attirent les innovateurs de stade précoce, tandis que les centres académiques se concentrent sur le développement de méthodes et la formation de la main-d'œuvre plutôt que sur le travail commercial à haut débit.
Note: Parts de segments de tous les segments individuels disponibles à l'achat du rapport
Analyse géographique
L'Amérique du Nord contrôlait 39,32 % du marché des services de purification virale en 2024 et reste le nexus mondial pour le leadership réglementaire, le financement de capital-risque et les expansions d'usines à grande échelle. Le projet de 1,2 milliard USD de Fujifilm en Caroline du Nord triplera la production de bioréacteur d'ici 2031, créant une nouvelle demande pour la validation de purification intégrée. Les réseaux d'approvisionnement robustes pour les virus modèles qualifiés, plus la proximité avec les examinateurs FDA, renforcent l'importance stratégique de la région. La taille du marché des services de purification virale en Amérique du Nord devrait grimper de 380 millions USD en 2025 à 740 millions USD en 2030.
L'Europe maintient une présence substantielle soutenue par les orientations complètes de sécurité virale de l'Agence européenne des médicaments et la stratégie biotechnologique 2024 de la Commission européenne. Le hub de thérapie génique de 90 millions € de Roche en Allemagne et l'installation de vecteurs de 40 millions € de Novartis en Slovénie étendent la capacité régionale. Pourtant le paysage réglementaire multi-pays de l'Europe et les coûts de main-d'œuvre croissants tempèrent la croissance à des TCAC à un chiffre, gardant sa part stable plutôt qu'expansionniste.
L'Asie-Pacifique est le moteur le plus rapide, progressant à un TCAC de 16,47 %. La décision de la Chine de lever les limites de propriété étrangère pour la thérapie cellulaire et génique dans les zones de libre-échange et la voie Sakigake accélérée du Japon raccourcissent les fenêtres d'approbation et attirent les sponsors multinationaux. Les CDMO régionales comme WuXi Biologics et Takara Bio investissent dans des suites de vecteurs et des trains de filtration virale à haute capacité. La taille du marché des services de purification virale en Asie-Pacifique est projetée pour bondir de 210 millions USD en 2025 à 450 millions USD d'ici 2030, comblant l'écart avec les hubs occidentaux établis. Les pénuries de talents persistent, pourtant les subventions gouvernementales et les partenariats universitaires visent à élargir le bassin de talents en virologie.
Paysage concurrentiel
Le marché des services de purification virale est modérément fragmenté mais tend vers la consolidation alors que les lignes de démarcation s'estompent entre les fournisseurs d'équipements, les laboratoires de tests et les CDMO de service complet. L'achat de Mirus Bio par Merck pour 600 millions USD sécurise l'expertise vectorielle, tandis que le rachat de Vigene Biosciences par Charles River pour 292,5 millions USD ajoute la production de vecteurs CGMP à un portefeuille de tests de sécurité déjà étendu. De telles transactions créent des guichets uniques qui plaisent aux sponsors de thérapie génique nécessitant à la fois des vecteurs GMP et une validation de purification sous un même toit.
Le leadership technologique sert de différenciateur. Le filtre FG1 de nouvelle génération d'Asahi Kasei, les plateformes de conception de protocole guidées par IA, et les modules de traitement en continu offrent des économies de temps et de coûts mesurables, augmentant les barrières de changement des clients. Les fournisseurs qui marient des filtres propriétaires avec des laboratoires de virologie internes peuvent verrouiller des accords de service maître pluriannuels.
Les opportunités d'espace blanc sont les plus riches dans les modalités sur mesure-virus oncolytiques, ARNm et thérapies cellulaires personnalisées-où les approches standardisées échouent. Les acteurs spécialisés utilisant l'apprentissage automatique pour prévoir la robustesse de purification ou les jumeaux numériques pour simuler l'élimination virale avant le travail de laboratoire humide sont des challengers émergents. Les alliances stratégiques entre les entreprises d'IA de niche et les CDMO établies accélèrent la commercialisation de tels outils.
La concurrence par les prix reste rationnelle en raison de la haute complexité technique et de l'examen réglementaire, pourtant les fournisseurs de niveau 2 en Asie offrent des forfaits groupés pour capturer les projets sensibles aux coûts. La protection de la propriété intellectuelle, l'intégrité des données et les antécédents réglementaires mondiaux continuent d'influencer la sélection des sponsors.
Leaders de l'industrie mondiale des services de purification virale
-
Charles River Laboratories
-
Lonza Group
-
Merck KGaA
-
Texcell SA
-
WuXi AppTec
- *Avis de non-responsabilité : les principaux acteurs sont triés sans ordre particulier
Développements récents de l'industrie
- Février 2025 : Hovione et iBET ont formé ViSync Technologies pour développer des solutions de livraison de médicaments pour les thérapies géniques et cellulaires, se concentrant sur la formulation et la fabrication de produits biologiques avancés.
- Février 2025 : BioCina et NovaCina ont conclu une fusion qui un créé une CDMO intégrée couvrant le développement de lignées cellulaires au remplissage-finition stérile.
- Janvier 2025 : Fujifilm Diosynth Biotechnologies un annoncé 8 milliards USD d'investissements mondiaux en biofabrication, incluant des plans pour doubler son site du Danemark et tripler les réacteurs de Caroline du Nord.
- Octobre 2024 : Asahi Kasei Medical un lancé le filtre d'élimination virale Planova FG1 présentant un flux plus élevé et une rétention améliorée pour les biothérapeutiques.
Portée du rapport sur le marché mondial des services de purification virale
Selon la portée du rapport, les services de purification virale incluent l'élimination des virus ou bactéries qui ont été laissés de manière non intentionnelle sur les équipements de production et les produits biologiques. Ces services incluent les tests des produits finis et des équipements pour tout virus et garantissent un développement sûr et cohérent des produits biologiques. Le marché des services de purification virale est segmenté par méthode (élimination virale, inactivation virale), application (protéines recombinantes, produits dérivés de tissus et de sang, vaccins, autres), par utilisateur final (biopharmaceutiques, organisations de recherche sous contrat, instituts de recherche académique), et géographie (Amérique du Nord, Europe, Asie-Pacifique, Moyen-Orient et Afrique, et Amérique du Sud). Le rapport de marché couvre également les tailles de marché estimées et les tendances pour 17 pays différents dans les principales régions, mondialement. Le rapport offre la valeur (en millions USD) pour les segments ci-dessus.
| Élimination virale | Chromatographie | Capture protéine A |
| Échange d'ions | ||
| Affinité et mode mixte | ||
| Filtration | Nanofiltration | |
| Filtration en profondeur | ||
| Adsorbeurs membranaires | ||
| Précipitation (PEG/éthanol) | ||
| Inactivation virale | Traitement solvant/détergent | |
| Incubation à pH bas | ||
| Irradiation UV-C | ||
| Chaleur/pasteurisation | ||
| Traitement haute pression | ||
| Stratégies hybrides | ||
| Protéines recombinantes |
| Anticorps monoclonaux |
| Produits dérivés de tissus et de sang |
| Vaccins |
| Thérapies géniques et cellulaires |
| Vecteurs viraux |
| Autres applications |
| Grandes pharmaceutiques |
| Petites et moyennes biotechs |
| Organisations de développement et fabrication sous contrat (CDMO) |
| Organisations de recherche et test sous contrat (CRO) |
| Instituts de recherche académique et gouvernemental |
| Amérique du Nord | États-Unis |
| Canada | |
| Mexique | |
| Europe | Allemagne |
| Royaume-Uni | |
| France | |
| Italie | |
| Espagne | |
| Reste de l'Europe | |
| Asie-Pacifique | Chine |
| Inde | |
| Japon | |
| Australie | |
| Corée du Sud | |
| Reste de l'Asie-Pacifique | |
| Moyen-Orient et Afrique | CCG |
| Afrique du Sud | |
| Reste du Moyen-Orient et Afrique | |
| Amérique du Sud | Brésil |
| Argentine | |
| Reste de l'Amérique du Sud |
| Par méthode | Élimination virale | Chromatographie | Capture protéine A |
| Échange d'ions | |||
| Affinité et mode mixte | |||
| Filtration | Nanofiltration | ||
| Filtration en profondeur | |||
| Adsorbeurs membranaires | |||
| Précipitation (PEG/éthanol) | |||
| Inactivation virale | Traitement solvant/détergent | ||
| Incubation à pH bas | |||
| Irradiation UV-C | |||
| Chaleur/pasteurisation | |||
| Traitement haute pression | |||
| Stratégies hybrides | |||
| Par application | Protéines recombinantes | ||
| Anticorps monoclonaux | |||
| Produits dérivés de tissus et de sang | |||
| Vaccins | |||
| Thérapies géniques et cellulaires | |||
| Vecteurs viraux | |||
| Autres applications | |||
| Par utilisateur final | Grandes pharmaceutiques | ||
| Petites et moyennes biotechs | |||
| Organisations de développement et fabrication sous contrat (CDMO) | |||
| Organisations de recherche et test sous contrat (CRO) | |||
| Instituts de recherche académique et gouvernemental | |||
| Par géographie | Amérique du Nord | États-Unis | |
| Canada | |||
| Mexique | |||
| Europe | Allemagne | ||
| Royaume-Uni | |||
| France | |||
| Italie | |||
| Espagne | |||
| Reste de l'Europe | |||
| Asie-Pacifique | Chine | ||
| Inde | |||
| Japon | |||
| Australie | |||
| Corée du Sud | |||
| Reste de l'Asie-Pacifique | |||
| Moyen-Orient et Afrique | CCG | ||
| Afrique du Sud | |||
| Reste du Moyen-Orient et Afrique | |||
| Amérique du Sud | Brésil | ||
| Argentine | |||
| Reste de l'Amérique du Sud | |||
Questions clés répondues dans le rapport
Quel changement réglementaire remodèle les stratégies de purification virale ?
La mise à jour Q5A(R2) de la FDA approuve la validation de plateforme basée sur le risque, permettant la réutilisation des données à travers plusieurs produits biologiques et raccourcissant les délais de développement globaux.
Quelle méthodologie de purification virale est actuellement favorisée dans le biotraitement commercial ?
Les étapes de chromatographie et de filtration en profondeur restent la fondation préférée de l'industrie car elles offrent des valeurs de réduction logarithmique prévisibles et s'intègrent facilement avec les trains aval fermés à usage unique.
Comment l'externalisation influence-t-elle la dynamique concurrentielle parmi les fournisseurs de services ?
Les sponsors biopharmaceutiques s'appuient de plus en plus sur les CDMO pour les études de biosécurité, provoquant des acquisitions de haute valeur qui groupent la production de vecteurs avec les tests de purification sous un même contrat.
Quelle innovation technologique stimule l'efficacité dans l'élimination virale ?
Les filtres à flux élevé de nouvelle génération tels que Planova FG1 augmentent le débit sans sacrifier la rétention, soutenant les flux de travail de traitement en continu dans la fabrication de grosses molécules.
Quel défi de talents contraint l'expansion des capacités ?
Une pénurie mondiale de virologues expérimentés et de professionnels de la biosécurité retarde les montées d'installations et pousse les entreprises à investir dans l'automatisation et les partenariats universitaires pour le développement de la main-d'œuvre.
Comment les thérapies cellulaires et géniques modifient-elles les exigences de purification virale ?
Les risques spécifiques aux vecteurs dans les plateformes AAV et lentivirales exigent des Panneaux de purification sur mesure et des essais de virus compétents pour la réplication qui vont au-delà des protocoles d'anticorps monoclonaux traditionnels.
Dernière mise à jour de la page le: