Taille et part du marché de la pharmacovigilance
Analyse du marché de la pharmacovigilance par Mordor Intelligence
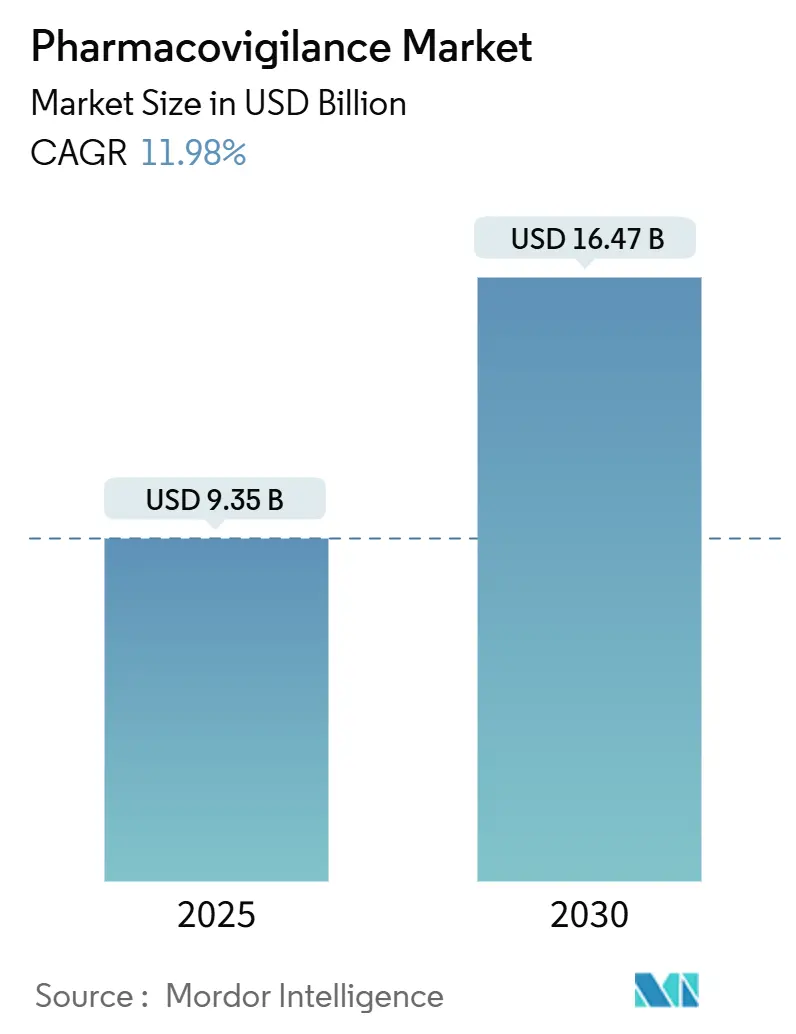
Le marché de la pharmacovigilance est évalué à 9,35 milliards USD en 2025 et devrait atteindre 16,47 milliards USD d'ici 2030, progressant à un TCAC de 11,98%. L'expansion des pipelines de médicaments, des règles de surveillance post-commercialisation plus strictes et l'adoption rapide de l'intelligence artificielle (IA) dans les flux de travail de surveillance de la sécurité soutiennent cette dynamique.[1]Agence européenne des médicaments, ' Guidance on the Application of the Amended Variations Regulation ', ema.europa.eu Les entreprises pharmaceutiques redirigent leurs ressources vers une gestion proactive de la sécurité à mesure que les biologiques, les thérapies géniques et autres modalités complexes entrent en usage commercial. Les organisations de recherche contractuelle (CRO) équipées de plateformes d'IA basées sur le cloud offrent une conformité rentable, accélérant le passage à l'externalisation. Les obligations de surveillance post-commercialisation augmentent les volumes de données, faisant de l'extraction de données des dossiers de santé électroniques (DSE) la méthode de déclaration à la croissance la plus rapide. L'Amérique du Nord conserve son leadership grâce à une science réglementaire mature, mais les initiatives d'harmonisation en Asie-Pacifique (APAC) propulsent la croissance à deux chiffres de cette région.[2]Food and Drug Administration, ' International Regulatory Harmonization ', fda.gov
Points clés du rapport
- Par prestataire de services, l'externalisation contractuelle menait avec 55,46% de part de revenus en 2024 ; le segment se développe à un TCAC de 13,73% jusqu'en 2030.
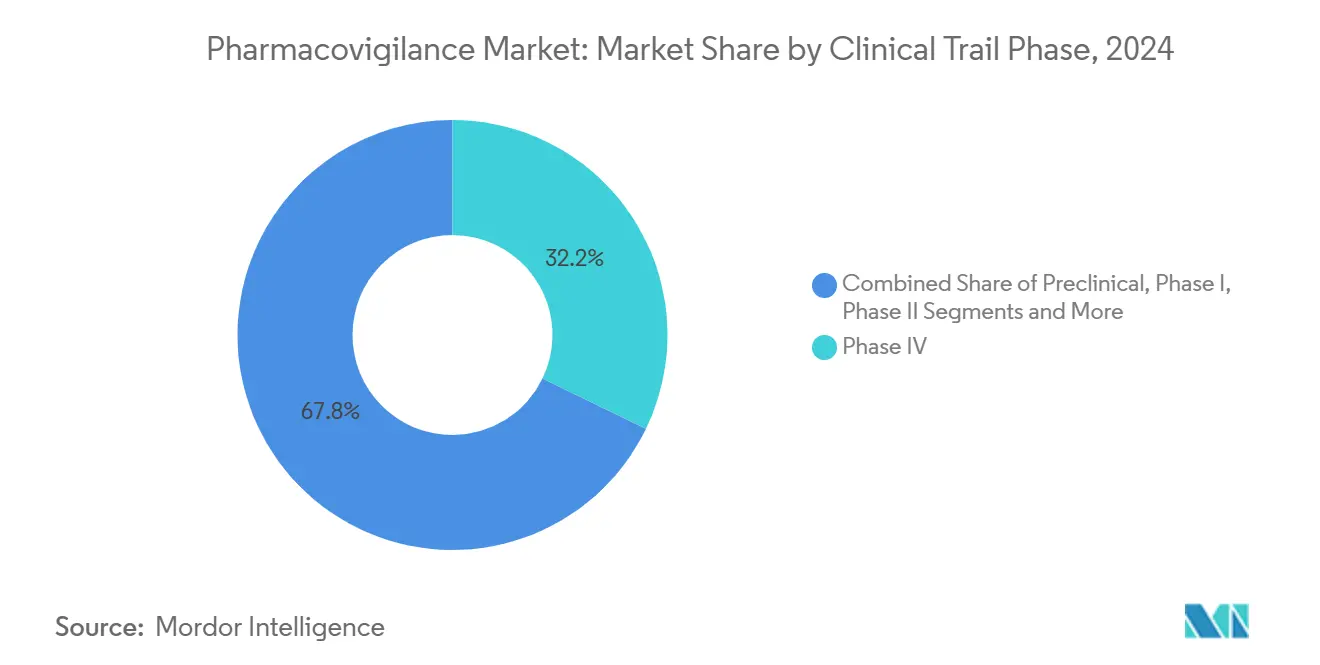
- Par phase d'essai clinique, les études post-commercialisation de phase IV détenaient 32,18% de la part du marché de la pharmacovigilance en 2024, tandis que les activités précliniques affichent le TCAC le plus élevé de 13,13% jusqu'en 2030.
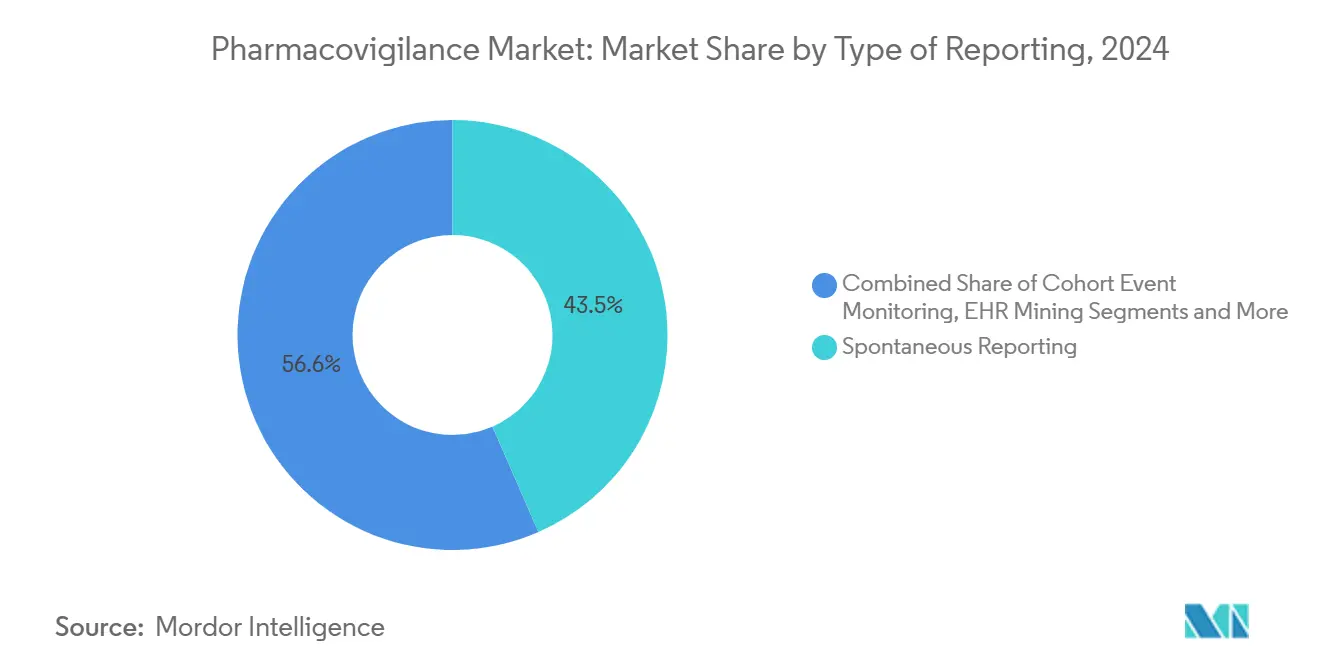
- Par type de déclaration, la déclaration spontanée commandait 43,45% de part de la taille du marché de la pharmacovigilance en 2024 ; l'extraction de données DSE devrait croître à un TCAC de 14,36% entre 2025-2030.
- Par utilisateur final, les entreprises pharmaceutiques représentaient 59,53% de part de la taille du marché de la pharmacovigilance en 2024 et les hôpitaux progressent à un TCAC de 14,45% jusqu'en 2030.
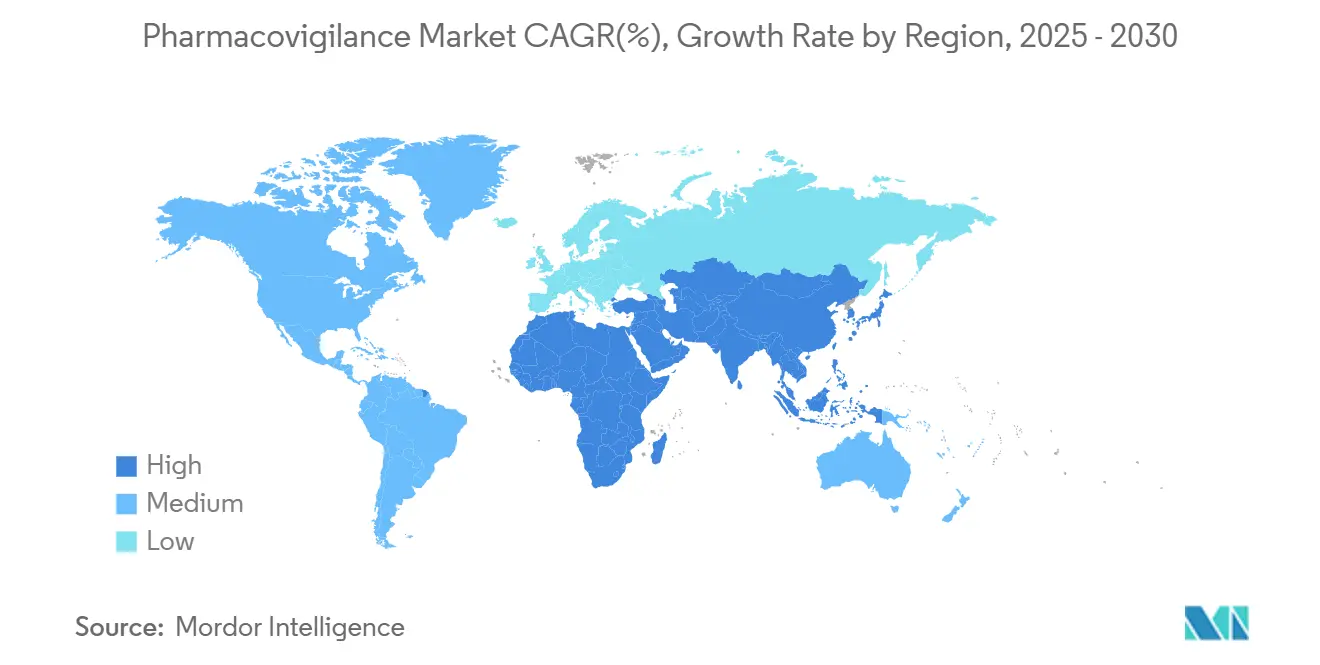
- Par géographie, l'Amérique du Nord détenait 44,18% de la part du marché de la pharmacovigilance en 2024, tandis que l'APAC enregistre le TCAC le plus rapide de 13,64% jusqu'en 2030.
Tendances et insights du marché mondial de la pharmacovigilance
Analyse d'impact des moteurs
| Moteur | (~) % d'impact sur les prévisions TCAC | Pertinence géographique | Calendrier d'impact |
|---|---|---|---|
| Consommation croissante de médicaments et pipeline de développement | +2.1% | Mondial | Long terme (≥ 4 ans) |
| Incidence croissante des réactions indésirables aux médicaments (RIM) | +1.8% | Mondial, populations vieillissantes | Moyen terme (2-4 ans) |
| Externalisation des services de PV vers les fournisseurs CRO/BPO | +2.3% | Amérique du Nord et UE, en hausse en APAC | Court terme (≤ 2 ans) |
| Détection de signaux alimentée par IA et analyses prédictives | +1.9% | Cœur Amérique du Nord et UE, retombées APAC | Moyen terme (2-4 ans) |
| Expansion des plateformes de preuves du monde réel (RWE) | +1.7% | États-Unis et UE en tête, diffusion mondiale | Long terme (≥ 4 ans) |
| Mandats réglementaires stricts pour la surveillance proactive de la sécurité post-commercialisation | +2.0% | Mondial | Long terme (≥ 4 ans) |
| Source: Mordor Intelligence | |||
Consommation croissante de médicaments et pipeline de développement
La FDA un approuvé 50 nouvelles entités moléculaires en 2024, soulignant comment les approbations révolutionnaires élargissent les devoirs de sécurité post-commercialisation pour chaque promoteur.[3]Food and Drug Administration, ' Drug and Biologic Approvals ', fda.gov Les thérapies géniques, les traitements CAR-T et les produits de combinaison présentent des profils de risque uniques qui nécessitent une surveillance vigilante tout au long du cycle de vie du produit. Les approbations conditionnelles renforcent davantage les attentes en matière de preuves du monde réel (RWE), redirigeant les budgets vers des infrastructures de surveillance continue. Ces dynamiques enferment les équipes de pharmacovigilance dans un cycle d'expansion à long terme qui maintient la croissance de la charge de travail au-delà du développement clinique.
Incidence croissante des réactions indésirables aux médicaments (RIM)
Le Comité d'évaluation des risques en pharmacovigilance (PRAC) de l'Agence européenne des médicaments (EMA) un récemment souligné la surveillance à vie pour les receveurs de CAR-T après avoir observé des malignités secondaires potentielles.[4]Agence européenne des médicaments, ' PRAC Meeting Highlights ', ema.europa.eu La polypharmacie chez les populations âgées multiplie les interactions médicament-médicament, poussant plus haut les volumes de cas de RIM. Le déploiement de vaccins de l'ère pandémique un validé l'importance des réseaux de détection de signaux à grande échelle capables de traiter des millions de rapports de sécurité en quelques semaines.
Externalisation des services de PV vers les fournisseurs CRO/BPO
Les promoteurs transfèrent de plus en plus les opérations complètes de pharmacovigilance aux CRO qui maintiennent des centres de conformité mondiaux et des moteurs d'IA spécialisés. Ces prestataires s'adaptent facilement aux juridictions, permettant aux entreprises de biotechnologie de taille moyenne de respecter des règles complexes sans supporter de lourds coûts fixes. Les modèles d'arbitrage de main-d'œuvre en Inde et en Europe de l'Est sont également attractifs, mais la différenciation repose désormais sur la prise en charge automatisée et la détection prédictive de signaux plutôt que sur de pures économies de coûts.
Détection de signaux alimentée par IA et analyses prédictives
IQVIA vise une réduction de 50% des dépenses de traitement de cas de routine en intégrant des copilotes de grands modèles de langage (LLM) dans les flux de travail quotidiens. Pendant ce temps, Oracle un intégré des fonctionnalités d'apprentissage automatique avancées dans sa plateforme de sécurité pour trier les alertes de littérature et automatiser la rédaction de récits. Les régulateurs ont répondu avec des orientations préliminaires qui fixent des attentes de validation pour l'utilisation de l'IA dans la gestion de la sécurité.
Analyse d'impact des contraintes
| Contrainte | (~) % d'impact sur les prévisions TCAC | Pertinence géographique | Calendrier d'impact |
|---|---|---|---|
| Risques de cybersécurité et de confidentialité des données | -1.4% | Mondial, élevé en UE et États-Unis | Court terme (≤ 2 ans) |
| Manque d'harmonisation réglementaire mondiale et de normes de données | -1.2% | Mondial, marchés émergents les plus touchés | Long terme (≥ 4 ans) |
| Pénurie de talents PV spécialisés et rotation élevée | -1.6% | Amérique du Nord et UE aigu | Moyen terme (2-4 ans) |
| Complexité des thérapies de combinaison et ATMP | -1.1% | Amérique du Nord et UE, en expansion | Long terme (≥ 4 ans) |
| Source: Mordor Intelligence | |||
Risques de cybersécurité et de confidentialité des données
Le déploiement cloud de données sensibles de patients expose les systèmes de sécurité aux rançongiciels et aux intrusions d'États-nations. Les récentes violations de données de santé ont forcé plusieurs promoteurs à suspendre les intégrations DSE pendant que des audits s'assuraient qu'aucune manipulation de signal de sécurité ne s'était produite. Le Règlement général sur la protection des données (RGPD) et des lois similaires imposent des stratégies de minimisation et de localisation des données qui entrent parfois en conflit avec les ambitions d'analyses mondiales.
Pénurie de talents PV spécialisés et rotation élevée du personnel
Les enquêtes sectorielles projettent une pénurie de 35% de professionnels de pharmacovigilance qualifiés d'ici 2030 à mesure que les compétences en IA, les connaissances réglementaires et la spécialisation thérapeutique convergent en un seul profil. Les organisations répondent avec des programmes d'apprentissage et des académies internes, mais les temps de montée en compétences peuvent dépasser deux ans, créant des goulots d'étranglement à court terme.
Analyse des segments
Par phase d'essai clinique : La surveillance post-commercialisation stimule la croissance
Les études de phase IV détenaient 32,18% de la part du marché de la pharmacovigilance en 2024, reflétant la demande des régulateurs pour une surveillance à vie des thérapies innovantes. La taille du marché de la pharmacovigilance liée aux évaluations de sécurité précliniques devrait s'étendre à un TCAC de 13,13% grâce aux analyses de phase précoce basées sur le risque. Les conceptions d'essais adaptatifs raccourcissent les phases II et III, mais renforcent l'importance de la détection de signaux haute-fidélité une fois que les produits atteignent de larges populations. Les directives ICH E6(R3) mises à jour contraignent les promoteurs à intégrer des métriques de qualité par conception dans toutes les phases, assurant une capture de données de sécurité traçable depuis le premier dosage chez l'homme.
Le marché de la pharmacovigilance répond en intégrant des essais décentralisés avec échantillonnage direct au patient et capteurs portables. Les modèles d'IA simulent les effets hors cible avant le premier dosage patient, donnant aux entreprises une longueur d'avance dans la planification de gestion des risques. Alors que les approbations conditionnelles augmentent, les budgets d'études de sécurité post-autorisation (PASS) dépassent les dépenses traditionnelles de phase III, verrouillant la domination de phase IV dans les perspectives à long terme.
Note: Parts de segments de tous les segments individuels disponibles à l'achat du rapport
Par prestataire de services : L'externalisation s'accélère grâce à l'intégration technologique
L'externalisation contractuelle contrôlait 55,46% des revenus globaux en 2024 et devrait croître à 13,73% jusqu'en 2030, conservant la plus grande part du marché de la pharmacovigilance. Les unités internes conservent la prise de décision critique mais s'appuient de plus en plus sur des modèles hybrides où les plateformes CRO traitent les tâches routinières. Les alliances stratégiques telles que le pacte IA pluriannuel de Parexel avec Palantir exemplifient comment les CRO renforcées par la technologie cultivent un avantage concurrentiel.
L'industrie de la pharmacovigilance valorise désormais les lacs de données évolutifs, le traitement du langage naturel (NLP) pour la littérature scientifique et l'automatisation robotique des processus dans la prise en charge. En conséquence, même les grandes entreprises pharmaceutiques migrent les charges de travail vers des centres externes en Inde, en Irlande et en Europe de l'Est, consolidant des listes de fournisseurs fragmentées en accords de service maître qui garantissent des feuilles de route d'investissement IA.
Par type de déclaration : L'extraction de données DSE émerge comme perturbateur technologique
La déclaration spontanée demeurait l'épine dorsale à 43,45% en 2024, mais la taille du marché de la pharmacovigilance liée à l'extraction de données DSE devrait afficher le TCAC le plus rapide de 14,36%. Les orientations finales de la FDA sur les RWE ouvrent la porte à l'extraction automatisée de données cliniques structurées et non structurées pour augmenter les soumissions de cas traditionnelles.
Les algorithmes d'IA analysent les notes de médecins, les résultats de laboratoire et les référentiels d'imagerie pour révéler des tendances de sécurité cachées des semaines plus tôt que les rapports spontanés. Des projets tels qu'ARTEMIS de Sanofi traitent plus de 700 000 cas annuellement avec des moteurs NLP, libérant les experts humains pour l'analyse des causes profondes. Les obstacles de standardisation persistent, particulièrement autour de la provenance des données, mais la trajectoire vers l'ingestion automatisée de RWE est claire.
Note: Parts de segments de tous les segments individuels disponibles à l'achat du rapport
Par utilisateur final : L'intégration hospitalière transforme la surveillance de la sécurité
Les entreprises pharmaceutiques détenaient 59,53% des dépenses 2024, mais les systèmes hospitaliers enregistrent le TCAC le plus élevé de 14,45% à mesure que les essais décentralisés et pragmatiques placent les responsabilités de sécurité plus près du point de soins. La taille du marché de la pharmacovigilance associée aux réseaux de prestation intégrés augmente à mesure que les hôpitaux déploient des plateformes RWE qui alimentent les promoteurs en données de sécurité quasi temps réel.
Le pacte quinquennal de BARDA avec Allucent illustre comment le financement gouvernemental accélère la participation hospitalière aux essais de contre-mesures. Pourtant, les écarts d'interopérabilité et les réglementations de confidentialité ralentissent encore l'échange de données transfrontalier, prolongeant la période de transition.
Analyse géographique
L'Amérique du Nord un capturé 44,18% du marché de la pharmacovigilance en 2024 en raison d'une intensité R&D élevée, d'une pénétration DSE avancée et d'attentes réglementaires claires. Les pilotes IA gagnent une acceptation rapide à mesure que la FDA publie des cadres de validation par étapes, positionnant la région comme référence mondiale pour la pharmacovigilance numérique.
L'Europe suit avec une législation mature sous-tendant le réseau EudraVigilance et de nouveaux documents de réflexion IA qui encouragent l'innovation tout en exigeant la transparence des algorithmes. L'accent sur les médicaments de thérapie avancée apporte des besoins de surveillance spécialisés, soutenant l'investissement jusqu'en 2030. La taille du marché de la pharmacovigilance pour les PASS basées en UE croît parallèlement aux approbations de médicaments orphelins.
L'Asie-Pacifique devrait enregistrer un TCAC de 13,64%, le plus rapide au monde, à mesure que les réformes réglementaires de la Chine et le paysage élargi d'essais cliniques de l'Inde convergent. Les nations ASEAN alignent les normes d'étiquetage et de soumission électronique, simplifiant les campagnes de sécurité multi-pays. Les investissements dans la fabrication biotechnologique domestique stimulent la demande pour des centres de traitement de cas localisés. Le Moyen-Orient et l'Afrique et l'Amérique du Sud ajoutent une croissance incrémentielle où l'infrastructure de pharmacovigilance s'adapte aux volumes d'importation pharmaceutique et aux clusters de fabrication émergents.
Paysage concurrentiel
Le marché de la pharmacovigilance montre une fragmentation modérée. IQVIA, ICON et Parexel maintiennent d'importantes empreintes mondiales, mais les fournisseurs axés logiciel tels qu'ArisGlobal et Oracle réduisent l'écart grâce aux offres centrées IA. ArisGlobal un mis à niveau sa suite LifeSphere avec un triage alimenté par LLM et un vu une vague record de nouveaux clients en 2024.
Les accords stratégiques définissent le récit concurrentiel. L'acquisition de PRA Health Sciences par ICON un consolidé deux CRO de service complet sous une plateforme IA, augmentant l'échelle tant dans les études post-commercialisation que du monde réel. La collaboration de Sanofi avec OpenAI et Formation Bio signale l'intérêt des grandes entreprises pharmaceutiques pour l'intégration verticale du développement de logiciels IA.
Des niches d'espaces blancs persistent dans la surveillance avancée de thérapie cellulaire et génique, la sécurité des médicaments pédiatriques et les solutions NLP pour les documents sources japonais et mandarin. Les nouveaux entrants offrant des clouds de sécurité plug-and-play ou des modèles d'échange de données basés sur des jetons pourraient capturer des parts aux acteurs établis lents à moderniser les plateformes héritées.
Leaders de l'industrie de la pharmacovigilance
Cognizant
Capgemini
Accenture
Wipro Limited
IBM
- *Avis de non-responsabilité : les principaux acteurs sont triés sans ordre particulier
Développements récents de l'industrie
- Janvier 2025 : ArisGlobal un rapporté une croissance significative de clientèle et des améliorations de produits à travers sa plateforme LifeSphere.
- Septembre 2024 : IQVIA un lancé son Assistant IA pour accélérer la détection de signaux en synthétisant de vastes jeux de données de santé.
- Septembre 2024 : Boehringer Ingelheim un étendu la plateforme LifeSphere MultiVigilance au Japon, renforçant les capacités APAC.
- Mai 2024 : Sanofi, Formation Bio et OpenAI ont dévoilé un partenariat IA pour raccourcir les délais de développement de médicaments et de sécurité.
Portée du rapport mondial sur le marché de la pharmacovigilance
La pharmacovigilance est la science et le groupe d'activités liées à la détection, l'évaluation, la compréhension et la prévention des effets indésirables ou de tout autre problème lié aux médicaments. La pharmacovigilance se concentre sur les RIM (réactions indésirables aux médicaments) et la toxicité des médicaments. Le marché de la pharmacovigilance comprend tous les types de déclaration d'événements indésirables menée pendant les essais cliniques dans les hôpitaux, pharmacies et autres secteurs de soins de santé. Le marché de la pharmacovigilance est segmenté par phase d'essai clinique (préclinique, phase I, phase II, phase III et phase IV), prestataire de services (interne et externalisation contractuelle), type de déclaration (déclaration spontanée, déclaration intensifiée de RIM, déclaration spontanée ciblée, surveillance d'événements de cohorte et extraction de données DSE), utilisateur final (hôpitaux, entreprises pharmaceutiques et autres utilisateurs finaux), et géographie (Amérique du Nord, Europe, Asie-Pacifique, Moyen-Orient et Afrique, et Amérique du Sud). Le rapport de marché couvre également les tailles de marché estimées et les tendances pour 17 pays différents dans les principales régions mondiales. Le rapport offre la valeur (en milliards USD) pour les segments ci-dessus.
| Préclinique |
| Phase I |
| Phase II |
| Phase III |
| Phase IV |
| Interne |
| Externalisation contractuelle |
| Déclaration spontanée |
| Déclaration intensifiée de RIM |
| Déclaration spontanée ciblée |
| Surveillance d'événements de cohorte |
| Extraction de données DSE |
| Hôpitaux |
| Entreprises pharmaceutiques |
| CRO et autres utilisateurs finaux |
| Amérique du Nord | États-Unis |
| Canada | |
| Mexique | |
| Europe | Allemagne |
| Royaume-Uni | |
| France | |
| Italie | |
| Espagne | |
| Reste de l'Europe | |
| Asie-Pacifique | Chine |
| Japon | |
| Inde | |
| Australie | |
| Corée du Sud | |
| Reste de l'Asie-Pacifique | |
| Moyen-Orient et Afrique | CCG |
| Afrique du Sud | |
| Reste du Moyen-Orient et de l'Afrique | |
| Amérique du Sud | Brésil |
| Argentine | |
| Reste de l'Amérique du Sud |
| Par phase d'essai clinique | Préclinique | |
| Phase I | ||
| Phase II | ||
| Phase III | ||
| Phase IV | ||
| Par prestataire de services | Interne | |
| Externalisation contractuelle | ||
| Par type de déclaration | Déclaration spontanée | |
| Déclaration intensifiée de RIM | ||
| Déclaration spontanée ciblée | ||
| Surveillance d'événements de cohorte | ||
| Extraction de données DSE | ||
| Par utilisateur final | Hôpitaux | |
| Entreprises pharmaceutiques | ||
| CRO et autres utilisateurs finaux | ||
| Par géographie | Amérique du Nord | États-Unis |
| Canada | ||
| Mexique | ||
| Europe | Allemagne | |
| Royaume-Uni | ||
| France | ||
| Italie | ||
| Espagne | ||
| Reste de l'Europe | ||
| Asie-Pacifique | Chine | |
| Japon | ||
| Inde | ||
| Australie | ||
| Corée du Sud | ||
| Reste de l'Asie-Pacifique | ||
| Moyen-Orient et Afrique | CCG | |
| Afrique du Sud | ||
| Reste du Moyen-Orient et de l'Afrique | ||
| Amérique du Sud | Brésil | |
| Argentine | ||
| Reste de l'Amérique du Sud | ||
Questions clés auxquelles répond le rapport
Quelle est la valeur actuelle du marché de la pharmacovigilance ?
Le marché de la pharmacovigilance est évalué à 9,35 milliards USD en 2025.
À quelle vitesse le marché de la pharmacovigilance croîtra-t-il jusqu'en 2030 ?
Il devrait s'étendre à un TCAC de 11,98%, atteignant 16,47 milliards USD d'ici 2030.
Quel modèle de service détient la plus grande part du marché de la pharmacovigilance ?
L'externalisation contractuelle mène avec 55,46% des revenus 2024.
Pourquoi l'Asie-Pacifique est-elle la région à croissance la plus rapide ?
L'harmonisation réglementaire à travers la Chine, l'Inde et les nations ASEAN plus de gros investissements manufacturiers stimulent le TCAC de 13,64% de l'APAC.
Dernière mise à jour de la page le: