Tamaño y Participación del Mercado Global de Pruebas y Certificación de Dispositivos Médicos
Análisis del Mercado Global de Pruebas y Certificación de Dispositivos Médicos por Mordor Intelligence
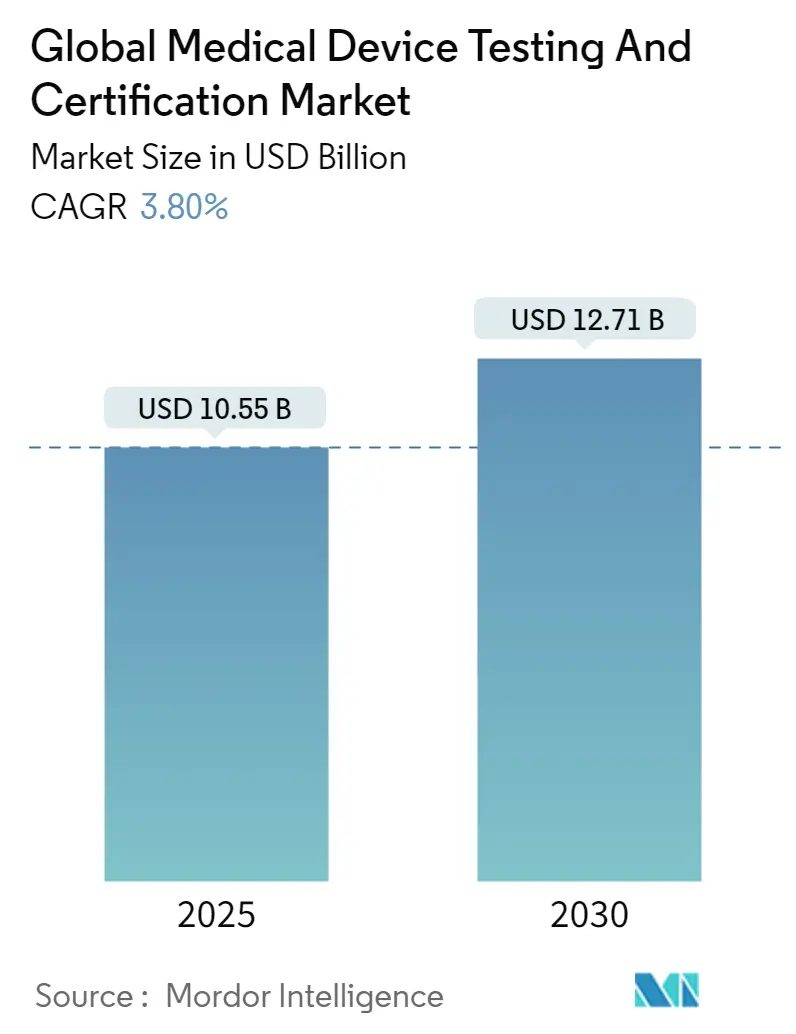
El mercado de servicios de pruebas y certificación de dispositivos médicos alcanzó un valor de 10,55 mil millones de USD en 2025 y se pronostica que alcanzará 12,71 mil millones de USD para 2030, avanzando a una TCAC del 3,8% durante el período. La demanda está moldeada por la aplicación simultánea del Reglamento de Dispositivos Médicos de la UE (MDR) y el mandato de ciberseguridad de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), ambos de los cuales amplían el alcance de validación y la profundidad de documentación. Los dispositivos de Clase II de riesgo medio dominan los volúmenes de cumplimiento, mientras que los algoritmos de IA/ML en proliferación y los diagnósticos domésticos conectados introducen protocolos de prueba novedosos que estimulan la demanda de servicios premium. América del Norte sigue siendo el líder en ingresos, aunque Asia-Pacífico está registrando la expansión de laboratorios más rápida porque China e India endurecieron las leyes nacionales de dispositivos en 2024, impulsando a productores extranjeros y domésticos a subcontratar ensayos complejos. Los participantes del mercado con acreditaciones multijurisdiccionales se benefician de las limitaciones persistentes de capacidad en los organismos notificados de la UE, que han duplicado los tiempos de entrega desde 2023. Las auditorías de sostenibilidad, impulsadas por las reglas de contratación pública europea, y las evaluaciones integrales de ciberseguridad están emergiendo como diferenciadores que permiten a los laboratorios cobrar márgenes más altos por compromisos integrados.
Conclusiones Clave del Informe
- Por tipo de servicio - Los servicios de pruebas capturaron el 56,56% de la participación del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024; se proyecta que las pruebas de software y ciberseguridad se expandirán a una TCAC del 5,2% hasta 2030.
- Por clase de dispositivo - Los dispositivos de Clase II representaron el 43,34% del tamaño del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024; el subsegmento lideró los ingresos y se espera que registre una TCAC del 5,7% entre 2025-2030.
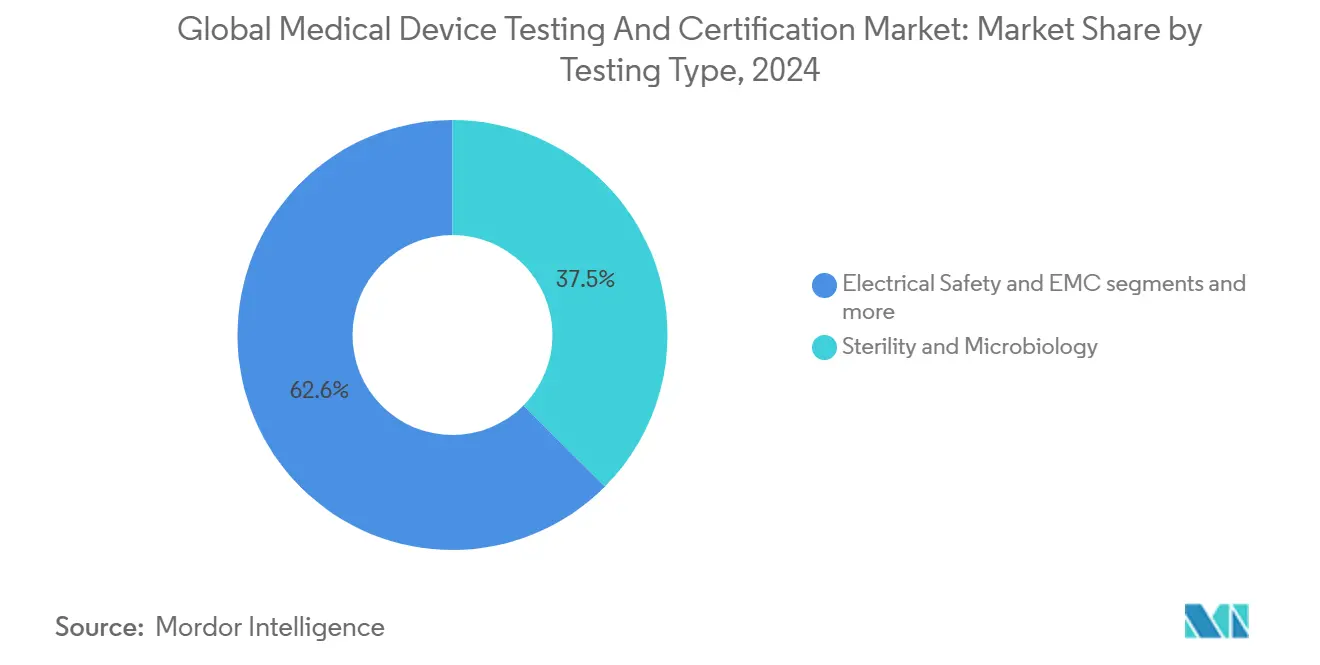
- Por tipo de prueba - Esterilidad y microbiología comandaron el 37,45% de participación del tamaño del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024; las pruebas de ciberseguridad es el subsegmento de crecimiento más rápido con una TCAC del 6,1%.
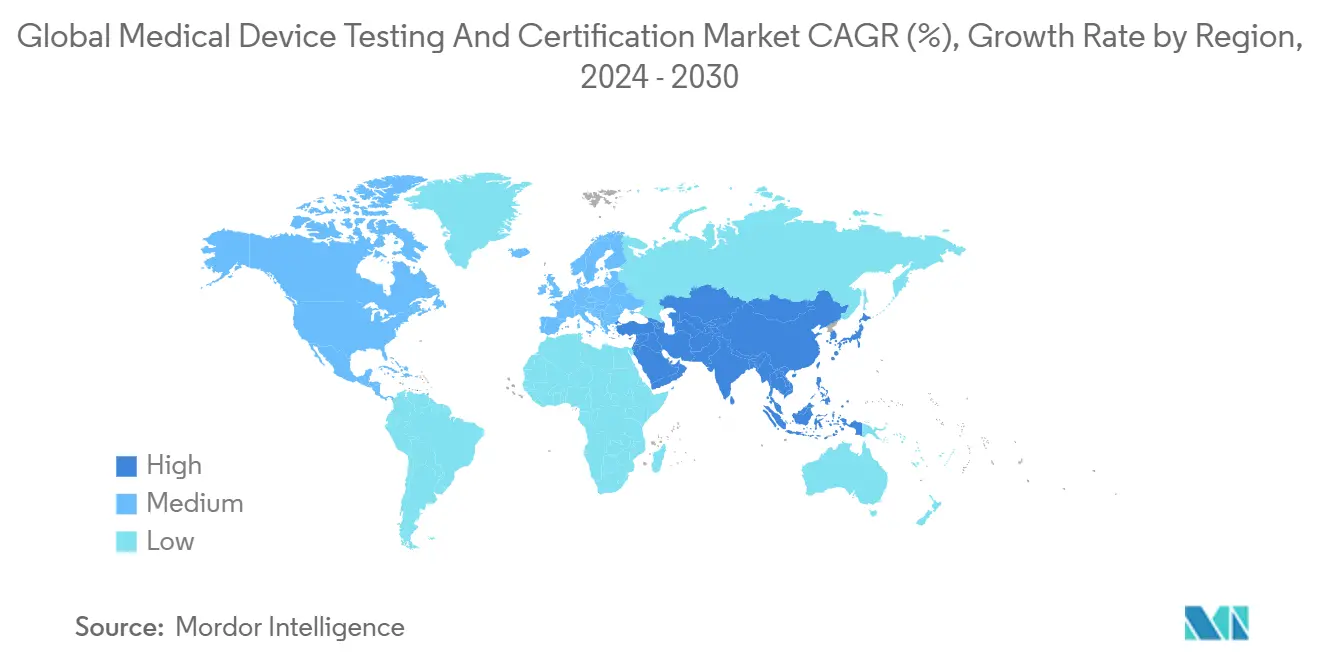
- Por geografía - América del Norte mantuvo el 38,95% de participación de ingresos en 2024, mientras que se pronostica que Asia-Pacífico registrará la TCAC más alta del 6,7% hasta 2030.
Tendencias y Perspectivas del Mercado Global de Pruebas y Certificación de Dispositivos Médicos
Análisis de Impacto de Impulsores
| Impulsor | (~) % Impacto en Pronóstico de TCAC | Relevancia Geográfica | Cronología de Impacto |
|---|---|---|---|
| Requisitos del MDR de la UE y la Ley de Dispositivos Más Seguros de la FDA actualizada | +1.2% | UE y América del Norte | Mediano plazo (2-4 años) |
| Adopción rápida de dispositivos médicos habilitados con IA/ML | +0.8% | América del Norte y UE, expandiéndose a Asia-Pacífico | Largo plazo (≥ 4 años) |
| Aumento en diagnósticos de uso doméstico y vestibles | +0.6% | Global; más fuerte en América del Norte y Asia-Pacífico | Corto plazo (≤ 2 años) |
| Envíos obligatorios de ciberseguridad previos a la comercialización | +0.5% | América del Norte, derrame a la UE | Corto plazo (≤ 2 años) |
| Criterios de contratación vinculados a sostenibilidad | +0.3% | UE primero, despliegue global | Largo plazo (≥ 4 años) |
| Certificaciones de mejora de habilidades de la fuerza laboral | +0.2% | Mercados desarrollados | Mediano plazo (2-4 años) |
| Fuente: Mordor Intelligence | |||
Endurecimiento regulatorio bajo MDR de la UE y Ley de Dispositivos Más Seguros de la FDA
La ventana de transición MDR 2024-2028 obliga a cada dispositivo heredado a volver a buscar el marcado CE bajo 23 Requisitos Generales de Seguridad y Rendimiento, triplicando la profundidad del archivo técnico para muchos fabricantes ec.europa.eu. Simultáneamente, la Sección 524B de la Ley de Dispositivos Más Seguros exige envíos previos a la comercialización en EE.UU. que incluyen Listas de Materiales de Software y planes de gestión de vulnerabilidades, expandiendo la documentación para cada producto conectado. El efecto combinado desencadenó un aumento del 40% en las aplicaciones de organismos notificados y alargó los tiempos de revisión promedio más allá de 24 meses, impulsando a las empresas a subcontratar paquetes de validación más grandes a laboratorios acreditados.
Aumento de dispositivos habilitados con IA/ML impulsando necesidades de validación especializada
La base de datos pública de la FDA registró 882 dispositivos médicos de IA/ML autorizados para mayo de 2024, un aumento del 45% interanual. Cada algoritmo demanda detección de sesgos, análisis de cambio de conjunto de datos y monitoreo de rendimiento en el mundo real, pruebas que exceden la verificación clásica. La Ley de IA de la UE, clasificando la IA médica como "alto riesgo", requiere además gestión de riesgos del ciclo de vida. Los laboratorios que ofrecen servicios de auditoría de algoritmos por tanto comandan precios premium, y se pronostica que esta línea de servicio se convierta en un pilar de ingresos central del mercado de servicios de pruebas y certificación de dispositivos médicos durante la próxima década.
Crecimiento de diagnósticos domésticos y vestibles expandiendo volúmenes de prueba
La familiaridad del consumidor de la era pandémica con kits de antígenos rápidos aceleró la adopción de glucómetros conectados, parches de ECG y vestibles multi-analito. Los reguladores ahora insisten en evidencia de usabilidad y factores humanos recopilada fuera de entornos clínicos, aumentando los recuentos de unidades de prueba en casi 30% anualmente para dispositivos de consumo de alto volumen. Los laboratorios capaces de ejecutar estudios de usuarios distribuidos y simulaciones de estrés ambiental atraen negocios continuos de marcas que buscan lanzamientos globales rápidos, reforzando el mercado de servicios de pruebas y certificación de dispositivos médicos.
Envíos obligatorios de ciberseguridad previos a la comercialización
Desde octubre de 2023, la FDA rechaza las presentaciones 510(k) que carecen de documentación de seguridad por diseño, y los dispositivos conectados lanzados sin una política de divulgación de vulnerabilidades arriesgan detención de importación. Las vías de certificación UL 2900 se han convertido en el punto de referencia de facto ul.com. Las casas de pruebas que invirtieron temprano en bancos de pruebas de penetración reportan líneas de proyectos llenas hasta mediados de 2026, afirmando la ciberseguridad como el nicho de ingresos de crecimiento más rápido dentro del mercado de servicios de pruebas y certificación de dispositivos médicos.
Análisis de Impacto de Restricciones
| Restricción | (~) % Impacto en Pronóstico de TCAC | Relevancia Geográfica | Cronología de Impacto |
|---|---|---|---|
| Capacidad limitada y largos tiempos de entrega en Organismos Notificados | -0.9% | UE principalmente, con efectos de derrame globales | Corto plazo (≤ 2 años) |
| Altos costos de pruebas para PYMEs y start-ups | -0.6% | Global, con mercados emergentes más afectados | Mediano plazo (2-4 años) |
| Escasez de conjuntos de datos estandarizados para validación de algoritmos de IA | -0.4% | Global, con América del Norte y UE liderando adopción de IA | Largo plazo (≥ 4 años) |
| Requisitos fragmentados de cumplimiento de sostenibilidad | -0.3% | Global, con UE y América del Norte priorizados | Mediano plazo (2-4 años) |
| Fuente: Mordor Intelligence | |||
Capacidad limitada y largos tiempos de entrega en organismos notificados
Solo 43 organismos notificados sirven a toda la UE bajo MDR, y las relaciones de aplicación a certificación exceden 4:1. Los tiempos de revisión promedio aumentaron de 14 meses en 2022 a más de 26 meses para fines de 2024. Los fabricantes han retirado consecuentemente ciertos productos de bajo margen de la UE, reduciendo volúmenes potenciales de prueba y moderando el crecimiento en el mercado de servicios de pruebas y certificación de dispositivos médicos.
Altos costos de pruebas para PYMEs y start-ups
Los paquetes integrales de biocompatibilidad, esterilidad, EMC y ciberseguridad empujan incluso las facturas de validación básica de Clase II por encima de 500.000 USD, un nivel que tensiona a las start-ups respaldadas por capital de riesgo. Aunque la FDA ofrece tarifas 510(k) reducidas a pequeñas empresas, esos ahorros cubren solo los costos de envío, no el trabajo de laboratorio. Muchas PYMEs difieren lanzamientos o pivotan a mercados con regulaciones más ligeras, reduciendo la demanda inmediata de servicios.
Análisis de Segmentos
Por Tipo de Servicio: Los servicios de pruebas siguen siendo fundamentales mientras la ciberseguridad se acelera
Los servicios de pruebas mantuvieron el 56,56% de la participación del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024, reflejando su estatus como el boleto de entrada regulatorio inevitable para todas las clases de dispositivos. Los servicios de certificación siguen atrás porque solo las rutas de la UE y Reino Unido requieren legalmente auditoría de terceros, mientras que EE.UU. se basa más en la auto-atestación del fabricante. Sin embargo, mientras los reguladores intensifican la vigilancia post-comercialización, los ingresos de inspección y auditoría están ganando impulso. La validación de ciberseguridad y software-aún estadísticamente anidada dentro de los servicios de pruebas-representa el flujo de ingresos más rápido, registrando una TCAC del 5,2% debido a los mandatos de la FDA y Health Canada. Los laboratorios que integran bancos biológicos, mecánicos y de seguridad digital en una ubicación reducen el tiempo total de respuesta hasta en un 30%, permitiendo facturación premium y reforzando la ventaja competitiva. Consecuentemente, el mercado de servicios de pruebas y certificación de dispositivos médicos está cambiando hacia contratos de aseguramiento de calidad agrupados, similares a suscripciones, que aseguran visibilidad de ingresos multi-anuales.
Las inversiones continuadas en preparación automatizada de muestras y analíticas de alto rendimiento han recortado la mano de obra directa por informe en casi 10% desde 2022, elevando los márgenes operativos. Los servicios de certificación, obstaculizados por la escasez de organismos notificados, se pronostica que crezcan a un 2,5% más lento pero siguen siendo indispensables para el acceso al mercado de la UE, sosteniendo un piso de ingresos defensivo.
Por Clase de Dispositivo: El punto óptimo de complejidad mantiene dominante a la Clase II
Los dispositivos de Clase II representaron el 43,34% del tamaño del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024 porque equilibran altos volúmenes unitarios con requisitos de evidencia estrictos. Los ejemplos incluyen bombas de infusión, sillas de ruedas motorizadas y muchos dispositivos de imágenes habilitados con IA. Bajo el Plan de Control de Cambios Predeterminado de la FDA, los desarrolladores pueden revisar algoritmos sin enviar un nuevo 510(k) siempre que validen los límites de rendimiento, efectivamente asegurando gasto de prueba recurrente cada vez que un modelo se actualiza. Los dispositivos de Clase III, aunque menores en número, entregan tarifas premium debido a la evidencia clínica obligatoria y niveles de aseguramiento de esterilidad de 10^−6. Los volúmenes de Clase I continúan migrando hacia auto-pruebas internas, sin embargo la cláusula de ciberseguridad está atrayendo algunos dispositivos conectados a laboratorios de terceros. Los Diagnósticos In Vitro (IVD) siguen siendo un bolsillo de crecimiento distinto después de que el IVDR de la UE extendió los plazos transicionales a 2028, sosteniendo atrasos de certificación elevados.
En general, el contenido creciente de software en productos de riesgo medio mantiene el mercado de servicios de pruebas y certificación de dispositivos médicos firmemente anclado en el espacio de Clase II.
Por Tipo de Prueba: Esterilidad mantiene escala; ciberseguridad impulsa momentum
Las pruebas de esterilidad y microbiología mantuvieron el 37,45% de participación de ingresos en 2024, respaldadas por aplicabilidad universal a través de implantes, desechables y productos de combinación. Las actualizaciones ISO 11737 sobre métodos microbianos rápidos alientan a los laboratorios a invertir en plataformas basadas en PCR que reducen el tiempo al certificado en 2-3 días. Paralelamente, las pruebas de ciberseguridad registraron el crecimiento más robusto con una TCAC del 6,1%, reflejando el giro legislado hacia dispositivos conectados digitalmente. La seguridad eléctrica y compatibilidad electromagnética (EMC) preservan relevancia porque el 100% de los nuevos dispositivos integran componentes inalámbricos. Los ensayos de empaque y vida útil disfrutan vientos de cola de materiales eco-amigables que requieren conjuntos de datos de estabilidad frescos.
Inversamente, las pruebas de esterilidad aumentan a un 3,1% más lento pero aún añaden casi 0,6 mil millones de USD en términos absolutos durante el lapso de pronóstico. Mientras los laboratorios venden de forma cruzada servicios digitales y microbiológicos, el valor promedio del proyecto aumenta, mejorando la resistencia del libro de órdenes.
Nota: Las participaciones de segmento de todos los segmentos individuales disponibles con la compra del informe
Análisis Geográfico
América del Norte capturó el 38,95% del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024, anclado por las vías simplificadas 510(k) y de Dispositivos Revolucionarios de la FDA que catalizan lanzamientos continuos de productos. Los laboratorios domésticos se benefician de sistemas de pagadores profundos que financian la innovación y de un ambiente regulatorio que reconoce explícitamente varios estándares de consenso voluntarios, acortando los ciclos de validación. De 2025-2030, la región está establecida para expandirse a una TCAC del 3,2%, más lenta que la media global debido a la madurez.
Asia-Pacífico es el claro motor de volumen, pronosticado para crecer 6,7% anualmente. El Reglamento de Dispositivos Médicos actualizado de China, efectivo julio 2024, compele a productores locales a asegurar datos de biocompatibilidad y empaque de terceros, impulsando flujos constantes de muestras a laboratorios regionales. La enmienda de las Reglas de Dispositivos Médicos de India de 2024 extendió los requisitos de auditoría de terceros a categorías adicionales de productos, añadiendo demanda incremental. Los jugadores extranjeros están abriendo rápidamente laboratorios satélite en Suzhou, Bangalore y Kuala Lumpur para capturar la marea creciente.
Europa sufrió arrastre a corto plazo de la escasez de organismos notificados; sin embargo, una vez que la capacidad se normalice, las aplicaciones diferidas se convertirán en pruebas facturables, ayudando a la región a recuperar impulso más allá de 2027. América Latina y Oriente Medio y África siguen siendo incipientes pero se benefician de iniciativas de armonización, que requieren prueba de cumplimiento con estándares de mercados de referencia-típicamente ejecutados por redes de laboratorios globales.
Panorama Competitivo
El panorama competitivo exhibe concentración moderada, con los proveedores clave-SGS SA, Intertek Group plc, Eurofins Scientific SE, TÜV SÜD y UL Solutions. Estas empresas aprovechan amplias carteras de acreditación que abarcan ISO/IEC 17025, ISO 13485 y múltiples reconocimientos de autoridades regulatorias para ganar contratos multi-territorio. SGS expandió las pruebas bioanalíticas de EE.UU. en enero de 2025 al asociarse con Agilex Biolabs, fortaleciendo su propuesta integral de pre-clínico hasta post-comercialización[1]Fuente: SGS, Inspección Excepcional de la FDA de EE.UU. Solidifica Posición como Líder en Pruebas Farmacéuticas en China,
SGS, sgs.com.
Intertek, TÜV SÜD y UL Solutions están desplegando sistemas automatizados de gestión de laboratorio que reducen errores de entrada de datos y aceleran la generación de informes, asegurando negocios repetidos con fabricantes multinacionales de dispositivos que buscan trazabilidad digital. Eurofins profundizó su cartera médica a través de la adquisición de diciembre de 2024 de Infinity Laboratories, añadiendo ocho instalaciones de EE.UU. especializadas en microbiología y pruebas de empaque[2]Fuente: Eurofins Scientific, "Adquisición de Infinity Laboratories," eurofins.com . Una ola de consolidaciones de nivel medio-Applus+ comprando Keystone Compliance y Apave adquiriendo Baltic Control-señala el impulso continuado por escala para equilibrar los costos generales de cumplimiento crecientes y ampliar la cobertura geográfica.
Los especialistas de nicho como Nelson Labs, BSI Group y Element Materials Technology mantienen posiciones de bastión en biocompatibilidad, certificación y EMC respectivamente. Defienden participación a través de experiencia técnica profunda, tiempo más rápido para programar y proximidad a centros de innovación. Sin embargo, la automatización de laboratorios y analíticas mejoradas con IA están estrechando las brechas de capacidades, permitiendo a rivales más grandes invadir territorios especializados. La competencia de precios permanece silenciada porque la complejidad regulatoria y los cuellos de botella de capacidad apoyan la facturación premium, sin embargo los clientes favorecen cada vez más acuerdos marco multi-anuales que agrupan pruebas a través de ciclos de vida de productos para asegurar descuentos.
Líderes de la Industria Global de Pruebas y Certificación de Dispositivos Médicos
-
Eurofins Scientific
-
SGS SA
-
TÜV SÜD
-
British Standards Institution
-
Intertek Group
- *Nota aclaratoria: los principales jugadores no se ordenaron de un modo en especial
Desarrollos Recientes de la Industria
- Febrero 2025: NAMSA y Terumo formaron una asociación global de subcontratación para acelerar la aprobación regulatoria de dispositivos cardiovasculares y endovasculares de Terumo, cubriendo servicios clínicos, de pruebas y consultoría.
- Enero 2025: SGS lanzó servicios bioanalíticos especializados en América del Norte a través de colaboración con Agilex Biolabs, mejorando el soporte de descubrimiento a través de fase 3 para productos combinados dispositivo-medicamento.
- Diciembre 2024: Eurofins Scientific adquirió Infinity Laboratories, añadiendo ocho laboratorios de EE.UU. enfocados en microbiología, química y pruebas de empaque para dispositivos médicos
Alcance del Informe del Mercado Global de Pruebas y Certificación de Dispositivos Médicos
Según el alcance del informe, las pruebas, certificación y auditoría de dispositivos médicos son necesarias para asegurar la seguridad de los dispositivos. Estas pruebas y certificación pueden ser proporcionadas por terceros bajo la organización auditora reconocida. El mercado global de pruebas y certificación de dispositivos médicos está segmentado por tipo de servicio (servicios de pruebas, servicios de inspección y servicios de certificación), tipo de abastecimiento (interno y subcontratado), clase de dispositivo (clase I, clase II y clase III), tecnología (dispositivo médico implantable activo, dispositivo médico activo, dispositivo médico no activo, dispositivo médico de diagnóstico in vitro, dispositivo médico oftálmico, dispositivo médico ortopédico y dental, y otras tecnologías), y geografía (América del Norte, Europa, Asia Pacífico, Oriente Medio y África, y América del Sur). El informe también ofrece el tamaño del mercado y pronósticos para 19 países a través de las regiones. El informe ofrece el valor (en millones de USD) para los segmentos anteriores.
| Servicios de Pruebas |
| Servicios de Certificación |
| Servicios de Inspección y Auditoría |
| Otros |
| Clase I |
| Clase II |
| Clase III |
| Dispositivos de Diagnóstico In Vitro |
| Pruebas de Biocompatibilidad |
| Pruebas de Esterilidad y Microbiología |
| Seguridad Eléctrica y EMC |
| Pruebas de Software y Ciberseguridad |
| Pruebas Mecánicas y Físicas |
| Pruebas de Empaque y Vida Útil |
| América del Norte | Estados Unidos |
| Canadá | |
| México | |
| Europa | Alemania |
| Reino Unido | |
| Francia | |
| Italia | |
| España | |
| Resto de Europa | |
| Asia-Pacífico | China |
| India | |
| Japón | |
| Corea del Sur | |
| Australia | |
| Resto de Asia-Pacífico | |
| América del Sur | Brasil |
| Argentina | |
| Resto de América del Sur | |
| Oriente Medio y África | CCG |
| Sudáfrica | |
| Resto de Oriente Medio y África |
| Por Tipo de Servicio (Valor) | Servicios de Pruebas | |
| Servicios de Certificación | ||
| Servicios de Inspección y Auditoría | ||
| Otros | ||
| Por Clase de Dispositivo (Valor) | Clase I | |
| Clase II | ||
| Clase III | ||
| Dispositivos de Diagnóstico In Vitro | ||
| Por Tipo de Prueba (Valor) | Pruebas de Biocompatibilidad | |
| Pruebas de Esterilidad y Microbiología | ||
| Seguridad Eléctrica y EMC | ||
| Pruebas de Software y Ciberseguridad | ||
| Pruebas Mecánicas y Físicas | ||
| Pruebas de Empaque y Vida Útil | ||
| Por Geografía (Valor) | América del Norte | Estados Unidos |
| Canadá | ||
| México | ||
| Europa | Alemania | |
| Reino Unido | ||
| Francia | ||
| Italia | ||
| España | ||
| Resto de Europa | ||
| Asia-Pacífico | China | |
| India | ||
| Japón | ||
| Corea del Sur | ||
| Australia | ||
| Resto de Asia-Pacífico | ||
| América del Sur | Brasil | |
| Argentina | ||
| Resto de América del Sur | ||
| Oriente Medio y África | CCG | |
| Sudáfrica | ||
| Resto de Oriente Medio y África | ||
Preguntas Clave Respondidas en el Informe
¿Cuál es el tamaño actual del mercado de servicios de pruebas y certificación de dispositivos médicos?
El tamaño del mercado de servicios de pruebas y certificación de dispositivos médicos alcanzó 10,55 mil millones de USD en 2025 y se proyecta que crezca a 12,71 mil millones de USD para 2030.
¿Qué segmento de servicio tiene la mayor participación?
Los servicios de pruebas, incluyendo ensayos de biocompatibilidad, esterilidad y ciberseguridad, capturaron el 56,56% de la participación del mercado de servicios de pruebas y certificación de dispositivos médicos en 2024.
¿Por qué los dispositivos de Clase II son el principal impulsor de ingresos?
Los dispositivos de Clase II combinan altos volúmenes de producción con requisitos de evidencia regulatoria de moderados a altos, convirtiéndolos en la fuente central de demanda para pruebas subcontratadas durante todo el período de pronóstico.
¿Cómo influirán las regulaciones de ciberseguridad en el crecimiento del mercado?
El mandato de la FDA para envíos de ciberseguridad previos a la comercialización y la adopción generalizada de estándares UL 2900 están alimentando una TCAC del 6,1% para servicios de pruebas de ciberseguridad hasta 2030, más rápido que cualquier otra categoría de prueba.
¿Qué región se espera que crezca más rápido?
Asia-Pacífico está establecido para registrar una TCAC del 6,7% gracias a marcos regulatorios más estrictos en China e India que compelen a los fabricantes a aumentar los volúmenes de pruebas de terceros.
Última actualización de la página el: