In-Vitro-Diagnostik Qualitätskontrolle Marktgröße und Anteil
In-Vitro-Diagnostik Qualitätskontrolle Marktanalyse von Mordor Intelligence
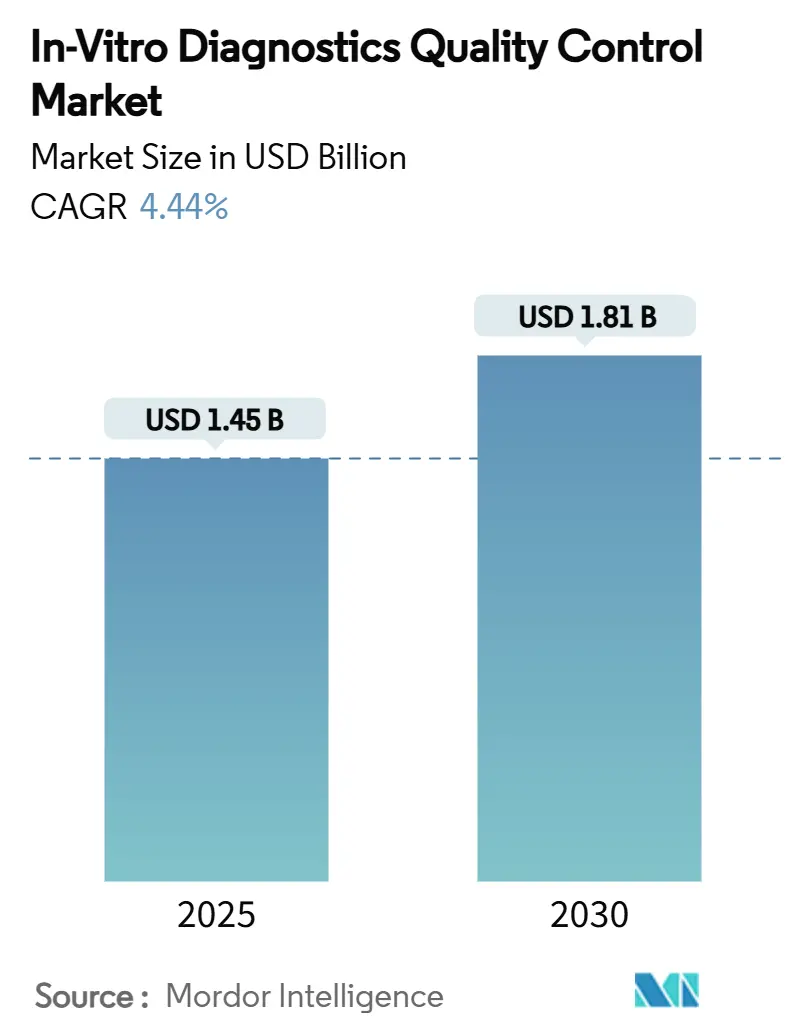
Die In-Vitro-Diagnostik Qualitätskontrolle Marktgröße wird auf 1,45 Milliarden USD in 2025 geschätzt und soll 1,81 Milliarden USD bis 2030 erreichen, mit einer CAGR von 4,44% während der Prognosezeitraums (2025-2030).
Dieses stetige Tempo spiegelt die rasche Hinwendung der Labore zu Echtzeitüberwachung, breiterer Point-of-Care-Adoption und strengen Akkreditierungsanforderungen wider. Asien-Pazifik expandiert am schnellsten, unterstützt durch staatlich finanzierte Testnetzwerke und ISO 15189-Einführungen, die die Nachfrage nach Drittanbieter-Materialien steigern. Qualitätskontrollprodukte dominieren weiterhin den Umsatz, doch Datenverwaltungslösungen skalieren schnell, da Labore Peer-Benchmarking-Dashboards suchen, die Fehler melden, bevor sie Patienten erreichen. Molekulardiagnostik, angetrieben durch Präzisionsmedizin-Protokolle, verschärft den Bedarf an synthetischen Kontrollen, die komplexe genbasierte Assays verifizieren können. Marktführer reagieren mit integrierten Software-plus-Material-Bündeln, die Compliance-Workflows optimieren.
Wichtige Berichts-Erkenntnisse
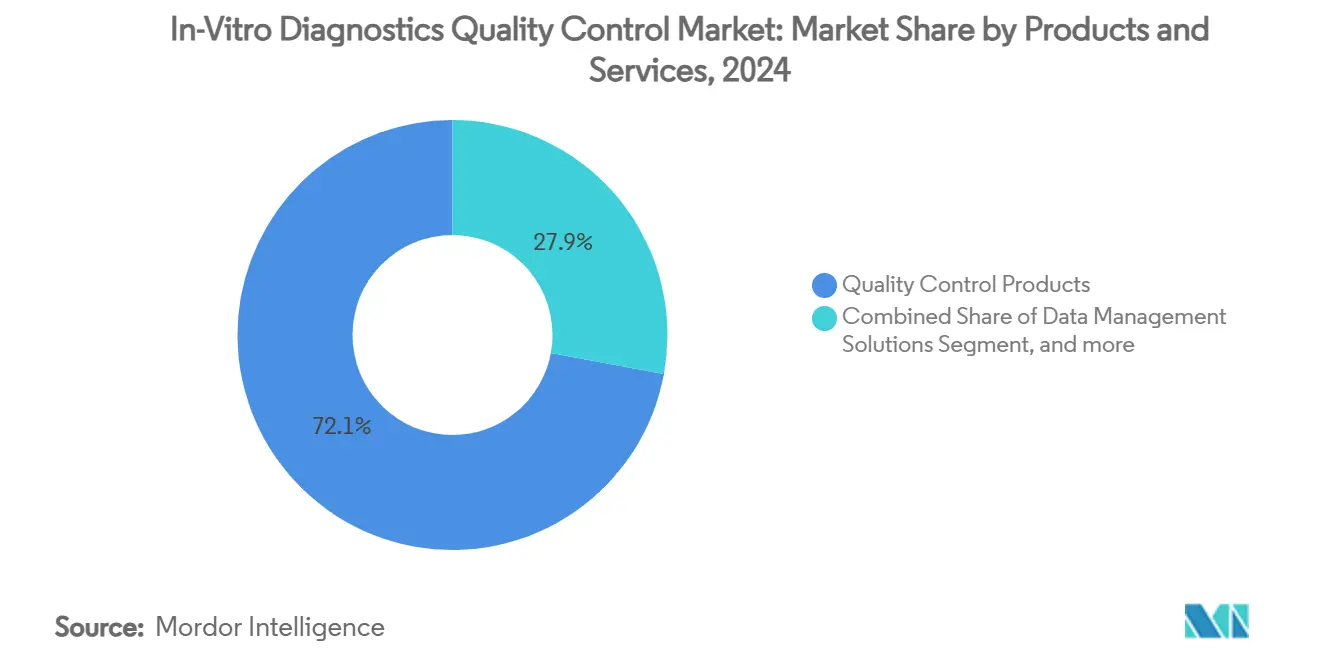
- Nach Produkten & Dienstleistungen führten Qualitätskontrollprodukte mit 72,14% des In-Vitro-Diagnostik Qualitätskontrolle Marktanteils in 2024, während Datenverwaltungslösungen eine CAGR von 11,23% bis 2030 verzeichnen sollen.
- Nach Anwendung hielt Immunchemie 31,48% Umsatzanteil in 2024; Molekulardiagnostik wird voraussichtlich mit einer CAGR von 4,89% während 2025-2030 voranschreiten.
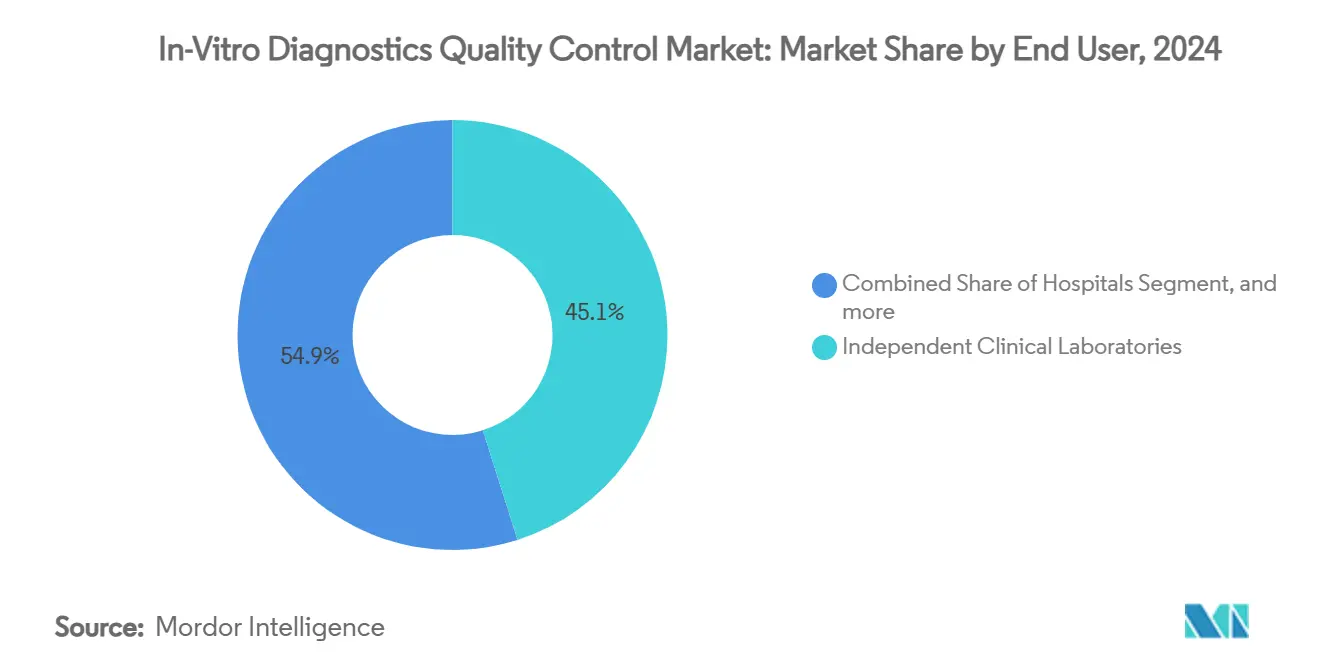
- Nach Endverbraucher machten klinische Labore 45,12% der In-Vitro-Diagnostik Qualitätskontrolle Marktgröße in 2024 aus, während IVD-Hersteller & CROs für eine CAGR von 10,37% bis 2030 positioniert sind.
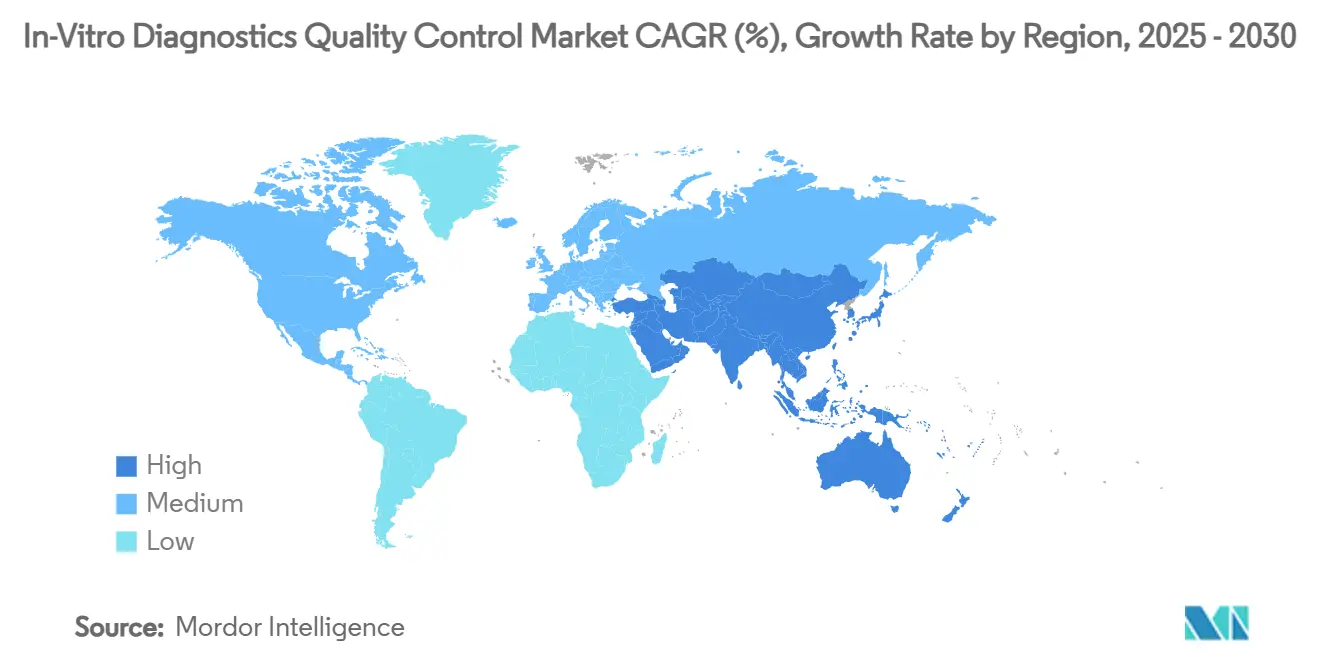
- Nach Geographie dominierte Nordamerika mit 45,26% Anteil des In-Vitro-Diagnostik Qualitätskontrolle Marktes in 2024, während Asien-Pazifik eine CAGR von 11,34% über denselben Zeitraum erwarten wird.
Globale In-Vitro-Diagnostik Qualitätskontrolle Markttrends und Einblicke
Treiber-Wirkungsanalyse
| Treiber | (~) % Auswirkung auf CAGR-Prognose | Geografische Relevanz | Auswirkungs- zeitrahmen |
|---|---|---|---|
| Erhöhte Nachfrage nach fortschrittlicher Diagnostik für sensitive Berichte und genaue Diagnose | +1.0% | Global, angeführt von Nordamerika & Europa | Mittelfristig (2-4 Jahre) |
| Anstieg der globalen Inzidenz von Infektionskrankheiten, Krebs und genetischen Störungen | +0.9% | Asien-Pazifik, Nordamerika | Kurzfristig (≤ 2 Jahre) |
| Anstieg des Volumens akkreditierter klinischer Labore und Adoption von Drittanbieter-Qualitätskontrollen | +0.8% | Global | Langfristig (≥ 4 Jahre) |
| Dezentralisierung der Tests treibt Point-of-Care QC-Nachfrage in Schwellenländern | +0.7% | Asien-Pazifik, Lateinamerika | Mittelfristig (2-4 Jahre) |
| Technologische Fortschritte bei molekularen IVD-Plattformen | +0.6% | Global | Langfristig (≥ 4 Jahre) |
| Globale Verlagerung hin zu regulatorischer Harmonisierung und ISO-Akkreditierung | +0.4% | Europa, Asien-Pazifik | Mittelfristig (2-4 Jahre) |
| Quelle: Mordor Intelligence | |||
Erhöhte Nachfrage nach fortschrittlicher Diagnostik für sensitive Berichte und genaue Diagnose
Molekulare Onkologie-Panels und Hochdurchsatz-Infektionskrankheits-Assays untermauern nun viele klinische Entscheidungen und zwingen Labore, die analytische Präzision zu verschärfen. Komplexe Multiplex-Tests erfordern Kontrollen, die Patientenproben nachahmen und über verschiedene Reagenzienchargen hinweg funktionieren, was die Adoption von Drittanbieter-Materialien antreibt, die zu internationalen Standards rückverfolgbar sind. Die Weltgesundheitsorganisation stellt fest, dass robustes Laborqualitätsmanagement zeitnahe, zuverlässige Testergebnisse untermauert.[1]World Health Organization, "Laboratory Quality Management System Handbook," who.int Mit steigender Assay-Komplexität werden Software-Dashboards, die Levy-Jennings-Plots in Echtzeit verfolgen, zur Routine und ermöglichen es Supervisoren, zu intervenieren, bevor Abweichungen die Ergebnisse beeinträchtigen. Anbieter bündeln solche Analytik mit Kontrollen, um Qualität in tägliche Arbeitsabläufe einzubetten und Laboren zu helfen, ISO 15189-Klauseln zur kontinuierlichen Verbesserung zu erfüllen.
Anstieg der globalen Inzidenz von Infektionskrankheiten, Krebs und genetischen Störungen
Häufige Ausbrüche und eine alternde Bevölkerung mit höherer Krebsprävalenz erweitern die molekularen Testvolumina und erhöhen die Bedeutung genauer QC. Während der COVID-19-Krise erhielten mehr als 300 molekulare Tests eine Notfallzulassung, doch die Leistung variierte stark und legte Lücken in herkömmlichen QC-Modellen offen. Der 360Dx Coronavirus Test Tracker verzeichnete Dutzende neuer Assays in den USA, der EU und Asien. Entwickler reagierten mit flexiblen, pathogenspezifischen Kontrollen, die Labore schnell kalibrieren konnten, als Varianten auftauchten. Ähnliche Innovationen erstrecken sich auf Atemwegspanels und erbliche Krebsscreenings, wo synthetische Kontrollen Arbeitsabläufe stabilisieren und Biosicherheitsrisiken eindämmen.
Anstieg des Volumens akkreditierter klinischer Labore und Adoption von Drittanbieter-Qualitätskontrollen
Akkreditierungsstellen betonen nun unvoreingenommene Qualitätsbewertung und veranlassen Labore, anbieterneutrale Kontrollen zu verwenden, die mit verschiedenen Instrumenten kompatibel sind. Das College of American Pathologists bietet über 700 Eignungsprüfungsprogramme an und verstärkt den Trend zu unabhängiger QC für objektives Benchmarking.[2]College of American Pathologists, "Proficiency Testing Programs," cap.org Peer-Group-Vergleiche in Echtzeit helfen kleineren Einrichtungen, die Leistung von Zentrallaboren zu erreichen und unterstützen Multi-Labor-Netzwerke, die einheitliche Ergebnisinterpretation anstreben. Da mehr Einrichtungen in Akkreditierungszyklen eintreten, beschleunigt sich die Nachfrage nach Multi-Analyt, konsolidierten Kontrollen, die die Kosten pro Test senken.
Dezentralisierung der Tests treibt Point-of-Care QC-Nachfrage in Schwellenländern
Bettseitige Tests in Notaufnahmen und ländlichen Kliniken nehmen zu, doch das Personal fehlt oft eine formale Laborausbildung. Das Centers for Disease Control and Prevention hebt die wichtige Rolle von POCT bei unmittelbaren Entscheidungen hervor.[3]Centers for Disease Control and Prevention, "Point-of-Care Testing," cdc.gov Tragbare kartuschenbasierte Kontrollen, die im selben Geräteslot wie Patientenproben laufen, vereinfachen die Compliance. Die Integration von Machine-Learning-Algorithmen in POCT-Reader automatisiert die Kennzeichnung von Drift, während Cloud-Dashboards es Supervisoren ermöglichen, mehrere entfernte Standorte zu überwachen. Asiatische Gesundheitsminister incentivieren nun Remote-Testprogramme und erhöhen das Volumen für einfach zu verwendende QC-Kits, die tropischen Transportbedingungen standhalten.
Hemmnis-Wirkungsanalyse
| Hemmnis | (~) % Auswirkung auf CAGR-Prognose | Geografische Relevanz | Auswirkungs- zeitrahmen |
|---|---|---|---|
| Ungünstige Erstattungsrichtlinien für IVD-Industrie | -0.7% | Nord- amerika, Europa | Kurzfristig (≤ 2 Jahre) |
| Mangel an strengen Vorschriften für klinische Laborakkreditierung in mehreren Schwellenländern | -0.6% | Asien-Pazifik, Afrika | Langfristig (≥ 4 Jahre) |
| Lieferketten- störungen, die QC-Materialverfügbarkeit beeinträchtigen | -0.5% | Global | Kurzfristig (≤ 2 Jahre) |
| Begrenzte digitale Infrastruktur in öffentlichen Laboren | -0.4% | Latein- amerika, Afrika | Mittelfristig (2-4 Jahre) |
| Quelle: Mordor Intelligence | |||
Ungünstige Erstattungsrichtlinien für IVD-Industrie
Niedrigere Zahlungssätze von öffentlichen und privaten Versicherern drücken die Margen klinischer Labore und erschweren die Finanzierung umfassender Qualitätskontrollprogramme. Jüngste Medicare-Gebührenkürzungen in den Vereinigten Staaten und ähnliche Tarifüberprüfungen in Europa haben die zulässigen Gebühren für Routine-Chemie- und Immunoassay-Tests reduziert, decken jedoch nicht die zusätzlichen Kosten fortschrittlicher Drittanbieter-Kontrollen ab. Viele Krankenhausnetzwerke verhandeln nun gebündelte Verträge, die Testpreise für mehrere Jahre begrenzen und die Flexibilität für Investitionen in neue QC-Plattformen weiter einschränken. Kleinere unabhängige Labore sind besonders betroffen; sie verschieben oft Software-Upgrades und verwenden weiterhin minimale tägliche Kontrollen, die nur die Grundliniencompliance erfüllen. Hersteller berichten von langsamerer Aufnahme von Premium-Datenanalyse-Paketen in Märkten, wo Erstattungsobergrenzen statisch bleiben.
Mangel an strengen Vorschriften für klinische Laborakkreditierung in mehreren Schwellenländern
Mehrere wachstumsstarke Regionen fehlen noch einheitliche Akkreditierungsrahmen vergleichbar mit dem US-CLIA-Programm, was zu inkonsistenten Qualitätsanforderungen zwischen lokalen Laboren führt. In vielen südostasiatischen und afrikanischen Ländern ist die Aufsicht zwischen mehreren Ministerien fragmentiert, und freiwillige Systeme wie die ISO 15189-Adoption bleiben auf größere städtische Zentren beschränkt. Diese regulatorische Lücke entmutigt kleinere Einrichtungen von Investitionen in Drittanbieter-Kontrollen, da es keinen klaren Durchsetzungsmechanismus oder Erstattungsanreiz gibt. Globale Anbieter stehen daher vor unvorhersehbaren Nachfragemustern und müssen erhebliche Ressourcen für Bildung und Interessenvertretung vor der kommerziellen Einführung einsetzen. Das Fehlen verpflichtender externer Qualitätsbewertungsprogramme bedeutet auch, dass Daten, die zur Demonstration von Leistungsvorteilen benötigt werden, knapp sind und die Verbreitung fortschrittlicher QC-Lösungen verlangsamen.
Segmentanalyse
Nach Produkten & Dienstleistungen: Datenverwaltungslösungen gestalten Qualitätssysteme um
Qualitätskontrollprodukte generierten den Großteil des Umsatzes in 2024 und sicherten sich 72,14% der In-Vitro-Diagnostik Qualitätskontrolle Marktgröße. Sie bleiben wesentlich für die tägliche Assay-Validierung, doch ihr Wachstum ist stetig statt spektakulär. Labormanager schwenken zu Datenverwaltungsplattformen um, die Middleware, Peer-Analytik und Akkreditierungsdokumentation integrieren. Diese Plattformen sollen eine CAGR von 11,23% bis 2030 verzeichnen und spiegeln einen strukturellen Sprung zu präventiven Qualitätsmodellen wider. Frühanwender berichten von kürzeren Troubleshooting-Zyklen und reduzierten Eignungsprüfungsfehlern, Ergebnisse, die direkt ISO 15189-Akkreditierungsaudits unterstützen.
Digitale Tools ermöglichen es Anbietern auch, Abonnementdienste wie Cloud-Speicher, mobile Benachrichtigungen und vorausschauende Wartung zu verkaufen. Die resultierenden wiederkehrenden Umsätze verbessern die Sichtbarkeit der Hersteller und reduzieren manuelle Diagrammerstellung für Labore. Da diese Plattformen Reagenzchargen-Verschiebungen über mehrere Analysatoren hinweg verfolgen, senken sie das Volumen verbrauchter physischer Kontrollen und erleichtern Versorgungsdruck während globaler Engpässe. Mit wachsendem Bewusstsein erkennen mehr Stakeholder, dass Datenverwaltungslösungen keine optionalen Add-ons mehr sind, sondern Kernkomponenten eines modernen Qualitätsökosystems, das die Evolution des In-Vitro-Diagnostik Qualitätskontrolle Marktes zu einem servicegetriebenen Modell untermauert.
Notiz: Segmentanteile aller einzelnen Segmente verfügbar beim Berichtskauf
Nach Anwendung: Molekulardiagnostik verstärkt Präzisionssicherung
Immunchemie behielt den größten Anteil mit 31,48% in 2024, unterstützt durch Routine-Hormon- und Tumormarker-Tests in Krankenhausnetzwerken. Dennoch ist Molekulardiagnostik darauf eingestellt, die schnellste Expansion mit einer CAGR von 4,89% zu verzeichnen und macht sie zu einem zentralen Katalysator für den In-Vitro-Diagnostik Qualitätskontrolle Markt. Labore, die Next-Generation-Sequenzierung und PCR-Panels für Onkologie einsetzen, validieren nun Hunderte von Targets in einem einzigen Lauf. Diese Komplexität vergrößert das Risiko falscher Ergebnisse, wenn Kontrollen genomische Vielfalt oder Stabilität fehlen. Synthetische DNA- und RNA-Kontrollen, die seltene Mutationen imitieren, gewinnen daher an Zugkraft und helfen Laboren, strenge Nachweisgrenzeansprüche zu erfüllen.
Entwickler entwickeln auch lyophilisierte, raumtemperaturstabile molekulare Kontrollen, die verlängerten Versand in entlegene Gebiete überstehen, eine Eigenschaft, die besonders in Asien-Pazifiks schnell wachsenden Umgebungen relevant ist. Da öffentliche Gesundheitsbehörden genomische Überwachung finanzieren, sehen Multi-Pathogen-Atemwegskontrollen breiteren Wochentageinsatz, was Anbieter dazu drängt, Produktionskapazität zu verfeinern. Diese Dynamik etabliert Molekulardiagnostik sowohl als Test- als auch als Qualitätsgrenze und beeinflusst Beschaffungsentscheidungen im globalen In-Vitro-Diagnostik Qualitätskontrolle Markt.
Nach Endverbraucher: IVD-Hersteller & CROs beschleunigen Compliance
Klinische Labore behielten weiterhin 45,12% des In-Vitro-Diagnostik Qualitätskontrolle Marktanteils in 2024. Sie bleiben die alltäglichen Käufer von Bulk-Flüssigkontrollen für Chemie- und Immunoassay-Analysatoren. Doch IVD-Hersteller und Auftragsforschungsorganisationen sind für eine CAGR von 10,37% bis 2030 vorgesehen und spiegeln steigende regulatorische Prüfung während der Produktentwicklung wider. Die US-amerikanische Food and Drug Administration unterstreicht die Notwendigkeit robuster Qualitätskontrollen bei der Suche nach Marktzulassung vor der Markteinführung. Da Testmenüs auf Heimsammlungs-Kits und Begleitdiagnostik erweitert werden, beschaffen sich Entwickler nun maßgeschneiderte Kontrollen früh im Designzyklus, um klinische Studienzeitleisten zu beschleunigen.
CROs, die groß angelegte Validierungsprojekte verwalten, übernehmen konsolidierte Drittanbieter-Kontrollen, um Chargen-zu-Chargen-Konsistenz über mehrere Untersuchungsstandorte zu gewährleisten. Diese Strategie mindert Wiederholungstest-Kosten und unterstützt reibungslosere regulatorische Einreichungen. Folglich haben sich Spezialanbieter, die kundenspezifische gespickte Matrizen oder Multiplex-synthetische Panels anbieten, eine Premium-Nische geschaffen und lenken den In-Vitro-Diagnostik Qualitätskontrolle Markt zu differenzierten Lösungen mit höheren Margen.
Notiz: Segmentanteile aller einzelnen Segmente verfügbar beim Berichtskauf
Geographieanalyse
Nordamerika führte mit 45,26% des 2024-Umsatzes, gestärkt durch CLIAs Aufsicht über etwa 320.000 Laboreinheiten, die tägliche QC-Leistung dokumentieren müssen. Die Region beherbergt auch die meisten Top-Reagenzienhersteller, was gleichtagige Wiederauffüllung und umfangreiche Feldservice-Unterstützung ermöglicht. Gesundheitssysteme skalieren Enterprise-Middleware, die QC-Daten über Krankenhausketten hinweg aggregiert und Bestellungen für interoperable Kontrollmaterialien und Analytics-Abonnements erhöht, die sich an Cybersicherheitsmandaten ausrichten. Darüber hinaus veranlassen Erstattungsdrücke Labore, patientenbasierte Echtzeit-QC zu übernehmen, was Verbrauchsmaterialien reduziert, aber stark von robusten Software-Algorithmen abhängt.
Asien-Pazifik mit einer regionalen CAGR von 11,34% bleibt der herausragende Wachstumsmotor für den In-Vitro-Diagnostik Qualitätskontrolle Markt. Chinas Vorstoß für gegenseitige Anerkennung von Laborergebnissen und Indiens Expansion nationaler Krebsscreening-Plattformen sind wichtige Rückenwindkräfte. Viele Provinzzentren in China haben auf ISO 15189 aufgerüstet und schaffen Nachfrage nach Drittanbieter-Kontrollen, die unvoreingenommene Testkriterien erfüllen. Regionale Distributoren berichten von erhöhtem Interesse an lyophilisierten Chemiekontrollen, die Warmketten-Logistik tolerieren, und Cloud-QC-Portale, lokalisiert in Mandarin oder Hindi, erfahren schnelle Adoption, da sie Akkreditierungsrückverfolgbarkeit vereinfachen.
Europa präsentiert eine reife, aber stetig evolvierende Landschaft. Harmonisierter Testergebnis-Austausch über Grenzen hinweg stimuliert Investitionen in Kontrollen, die gegen kommutierbare Referenzstandards verifiziert sind, um Vergleichbarkeit zwischen verschiedenen Analysatoren zu gewährleisten. Der europäische Trend zur Aufgabenverschiebung sieht mehr Schnelltests in der Primärversorgung ausgeführt und erweitert den Bedarf an kompakten QC-Fläschchen, verpackt mit detaillierten Fernschulungsmodulen. Anbieter, die Strichcode-Chargenregistrierung in lokale Laborinformationsmanagementsysteme integrieren, genießen stärkere Ausschreibungsgewinne und unterstützen mittleres einstelliges Wachstum in einer regulatorischen Umgebung, die dokumentierte Rückverfolgbarkeit schätzt.
Wettbewerbslandschaft
Der Wettbewerb ist moderat, wobei die drei führenden Unternehmen, Bio-Rad Laboratories, Abbott und Thermo Fisher Scientific, breite Portfolios nutzen, die Flüssigkontrollen, molekulare Panels und Cloud-Analytik abdecken. Bio-Rads Clinical Diagnostics-Segment verzeichnete 1,5 Milliarden USD Umsatz in 2024, verankert durch den Unity QC-Datendienst, der mehr als 45.000 Instrumente weltweit verbindet. Abbott bündelt weiterhin Chemiekontrollen mit seinen Analysatoren, doch die Präferenz der Akkreditierungsstellen für unabhängige Materialien drängt einige Labore zu Drittanbietern. Thermo Fisher stärkt seinen Footprint durch Reagenzien-Mietverträge, die Kontrollen mit automatisierungsfreundlichen Verbrauchsmaterialien verpacken und mehrjährige Verpflichtungen sichern.
Kleinere Spezialisten schaffen sich Nischen, indem sie sich auf synthetische Nukleinsäure-Kontrollen und Multiplex-Immunoassay-Verifizierungs-Kits konzentrieren. Ihre Agilität ermöglicht schnelle Reaktion auf aufkommende Pathogene, wie während jüngster Vogelgrippe-Alarme bewiesen, wo maßgeschneiderte Panels innerhalb von Wochen versandt wurden. Partnerschaften zwischen Kontrollherstellern und Middleware-Anbietern steigen; gemeinsame Lösungen reduzieren Integrationshürden und gewinnen Krankenhausgruppen-Ausschreibungen. Digitale Differenzierung ist entscheidend: Anbieter, die Cloud-Dashboards mit KI-gestützten Drift-Alarmen anbieten, berichten von höheren Verlängerungsraten, da Labore prädiktive Qualitätsaufsicht priorisieren.
Supply-Chain-Resilienz ist seit den pandemiebedingten Transportengpässen als Differenziator entstanden. Akteure mit regionalen Fertigungszentren in Europa und Asien genießen niedrigere Nachbestellungsraten und stärken die Markenwahrnehmung. Gleichzeitig beeinflussen Nachhaltigkeitsverpflichtungen die Beschaffung und drängen Anbieter, raumtemperaturstabile Produkte zu entwickeln, die die Trockeneis-Abhängigkeit reduzieren. Die Konvergenz von Materialwissenschaft und Informatik gestaltet daher sowohl Produktentwicklung als auch Go-to-Market-Taktiken in der In-Vitro-Diagnostik Qualitätskontrolle Branche um.
In-Vitro-Diagnostik Qualitätskontrolle Branchenführer
-
Abbott Laboratories
-
Thermo Fisher Scientific Inc.
-
F. Hoffmann-La Roche AG
-
Siemens Healthineers AG
-
Bio-Rad Laboratories Inc.
- *Haftungsausschluss: Hauptakteure in keiner bestimmten Reihenfolge sortiert
Aktuelle Branchenentwicklungen
- Februar 2025: Chinas State Drug Administration gab den YY/T 1898-2024 Standard für Testmethoden hydrophiler Beschichtungen auf intravaskulären Kathetern und Führungsdrähten heraus, der am 1. März 2025 implementiert werden soll.
- Januar 2025: Chinas National Medical Products Administration initiierte die Überarbeitung von neun Richtlinien, einschließlich derer für CYP2C9- und VKORC1-Gen-Polymorphismus-Testreagenzien und lud zur Branchenbeteiligung ein.
- Dezember 2024: Labcorp finalisierte die Akquisition ausgewählter Outreach-Services von Ballad Health und verstärkte seine Operationen in der Appalachian Highlands-Region.
- November 2024: Chinas National Health Commission und sechs andere Abteilungen gaben Richtlinien heraus, um die gegenseitige Anerkennung medizinischer Untersuchungsergebnisse zwischen Institutionen zu verbessern, mit Zielen für die vollständige Implementierung bis 2025.
Globaler In-Vitro-Diagnostik Qualitätskontrolle Marktbericht Umfang
Gemäß dem Umfang des Berichts werden In-Vitro-Diagnostik Qualitätskontrollen verwendet, um die Leistung von In-Vitro-Diagnostik-Tests zu bewerten, wie In-Vitro-Nukleinsäure-Testverfahren für Pathogenerkennung, gesundheitsassoziierte Infektionen (HAIs) wie Pneumonie und Harnwegsinfektionen. Diese Produkte konzentrieren sich hauptsächlich auf die Erkennung von Defekten, Qualitätskontrolle und Validierungspanels, wie das Human Papillomavirus (HPV) Control Panel und Blood Culture (BCID) Control Panel, um die Implementierung und Überwachung der Leistung klinischer und Forschungslabore, Blutdiagnosezentren und IVD-Hersteller zu unterstützen.
Der In-Vitro-Diagnostik Qualitätskontrolle Markt ist nach Produkten & Dienstleistungen, Anwendung, Endverbraucher und Geographie segmentiert. Nach Produkten & Dienstleistungen ist der Markt in Qualitätskontrollprodukte, Datenverwaltungslösungen und Qualitätssicherungsdienstleistungen segmentiert. Nach Anwendung umfasst Immunchemie, klinische Chemie, Hämatologie, Molekulardiagnostik, Koagulation / Hämostase, Mikrobiologie & Infektionskrankheiten und Point-of-Care-Testing. Nach Endverbraucher ist der Markt in Krankenhäuser, unabhängige klinische Labore, IVD-Hersteller & CROs, akademische & Forschungsinstitute und ambulante & Arztpraxis-Labore segmentiert. Nach Geographie ist der Markt in Nordamerika, Europa, Asien-Pazifik, Naher Osten & Afrika und Südamerika segmentiert. Für jedes Segment wurden Marktgrößen und Prognosen basierend auf Werten (USD) erstellt.
| Qualitätskontrollprodukte |
| Datenverwaltungslösungen |
| Qualitätssicherungsdienstleistungen |
| Immunchemie |
| Klinische Chemie |
| Hämatologie |
| Molekulardiagnostik |
| Koagulation / Hämostase |
| Mikrobiologie & Infektionskrankheiten |
| Point-of-Care-Testing |
| Krankenhäuser |
| Unabhängige klinische Labore |
| IVD-Hersteller & CROs |
| Akademische & Forschungsinstitute |
| Ambulante & Arztpraxis-Labore |
| Nordamerika | Vereinigte Staaten |
| Kanada | |
| Mexiko | |
| Europa | Deutschland |
| Vereinigtes Königreich | |
| Frankreich | |
| Italien | |
| Spanien | |
| Restliches Europa | |
| Asien-Pazifik | China |
| Japan | |
| Indien | |
| Australien | |
| Südkorea | |
| Restliches Asien-Pazifik | |
| Naher Osten & Afrika | GCC |
| Südafrika | |
| Restlicher Naher Osten & Afrika | |
| Südamerika | Brasilien |
| Argentinien | |
| Restliches Südamerika |
| Nach Produkten & Dienstleistungen | Qualitätskontrollprodukte | |
| Datenverwaltungslösungen | ||
| Qualitätssicherungsdienstleistungen | ||
| Nach Anwendung | Immunchemie | |
| Klinische Chemie | ||
| Hämatologie | ||
| Molekulardiagnostik | ||
| Koagulation / Hämostase | ||
| Mikrobiologie & Infektionskrankheiten | ||
| Point-of-Care-Testing | ||
| Nach Endverbraucher | Krankenhäuser | |
| Unabhängige klinische Labore | ||
| IVD-Hersteller & CROs | ||
| Akademische & Forschungsinstitute | ||
| Ambulante & Arztpraxis-Labore | ||
| Nach Geographie | Nordamerika | Vereinigte Staaten |
| Kanada | ||
| Mexiko | ||
| Europa | Deutschland | |
| Vereinigtes Königreich | ||
| Frankreich | ||
| Italien | ||
| Spanien | ||
| Restliches Europa | ||
| Asien-Pazifik | China | |
| Japan | ||
| Indien | ||
| Australien | ||
| Südkorea | ||
| Restliches Asien-Pazifik | ||
| Naher Osten & Afrika | GCC | |
| Südafrika | ||
| Restlicher Naher Osten & Afrika | ||
| Südamerika | Brasilien | |
| Argentinien | ||
| Restliches Südamerika | ||
Wichtige Fragen beantwortet im Bericht
Was macht Datenverwaltungslösungen zum am schnellsten wachsenden Segment?
Labore wenden sich Echtzeit-Dashboards und Peer-Benchmarking-Tools zu, die QC-Drift früh kennzeichnen und Datenverwaltungslösungen zu einer CAGR von 11,23% im In-Vitro-Diagnostik Qualitätskontrolle Markt treiben.
Warum wird Asien-Pazifik andere Regionen überholen?
Staatliche Investitionen, ISO 15189-Akkreditierungsanstöße und zentralisierte Beschaffungsprogramme in China und Indien untermauern die CAGR der Region von 11,34%.
Wie beeinflusst Point-of-Care-Testing Qualitätskontroll-Einkäufe?
Dezentralisierung erhöht die Nachfrage nach kartuschenbasierten Kontrollen und Cloud-Analytik, die Nicht-Laborpersonal einfach bedienen kann, während sie dennoch Akkreditierungsregeln erfüllen.
Warum werden Drittanbieter-Kontrollen gegenüber herstellerbereitgestellten Materialien bevorzugt?
Regulatoren und Akkreditierungsstellen schätzen unvoreingenommene Leistungsbewertung und veranlassen Labore, unabhängige Kontrollen zu übernehmen, die mit mehreren Analysatoren für genaues Benchmarking kompatibel sind.
Wie beeinflussen Erstattungskürzungen QC-Budgets?
Niedrigere Testzahlungen ermutigen Labore, patientenbasierte Echtzeit-QC und mehrjährige Service-Bundles zu übernehmen, die Verbrauchsmaterialien reduzieren und Ausgaben stabilisieren.
Seite zuletzt aktualisiert am: