Tamaño y Participación del Mercado de Pruebas de Seguridad Biológica
Análisis del Mercado de Pruebas de Seguridad Biológica por Mordor Intelligence
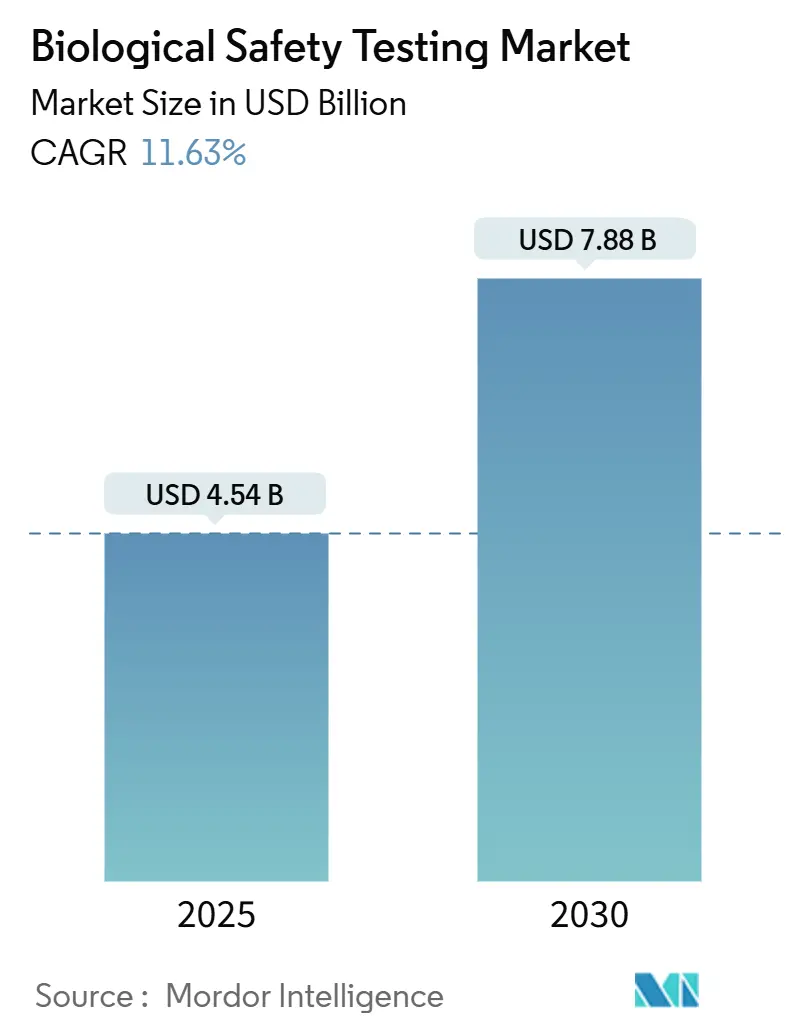
El tamaño del Mercado de Pruebas de Seguridad Biológica se estima en USD 4,54 mil millones en 2025, y se espera que alcance USD 7,88 mil millones en 2030, a una TCAC del 11,63% durante el período de pronóstico (2025-2030).
Las agencias regulatorias ahora demandan conjuntos de datos de seguridad viral y micoplásmica más ricos, mientras los fabricantes escalan productos medicinales de terapia avanzada (ATMP) que requieren control intensivo de contaminación. El modelado de bioseguridad in-silico habilitado por IA se incorpora cada vez más en los flujos de trabajo de control de calidad, reduciendo las tasas de falla de lotes y acortando los tiempos de liberación. El gasto en preparación para bioamenazas de BARDA y EU-HERA ha ampliado la demanda más allá de la base tradicional de clientes de biofarmacia. El control de calidad subcontratado a CDMO con base en Asia, especialmente en China, está remodelando las cadenas de suministro mientras los laboratorios allí obtienen acreditación internacional.
Conclusiones Clave del Informe
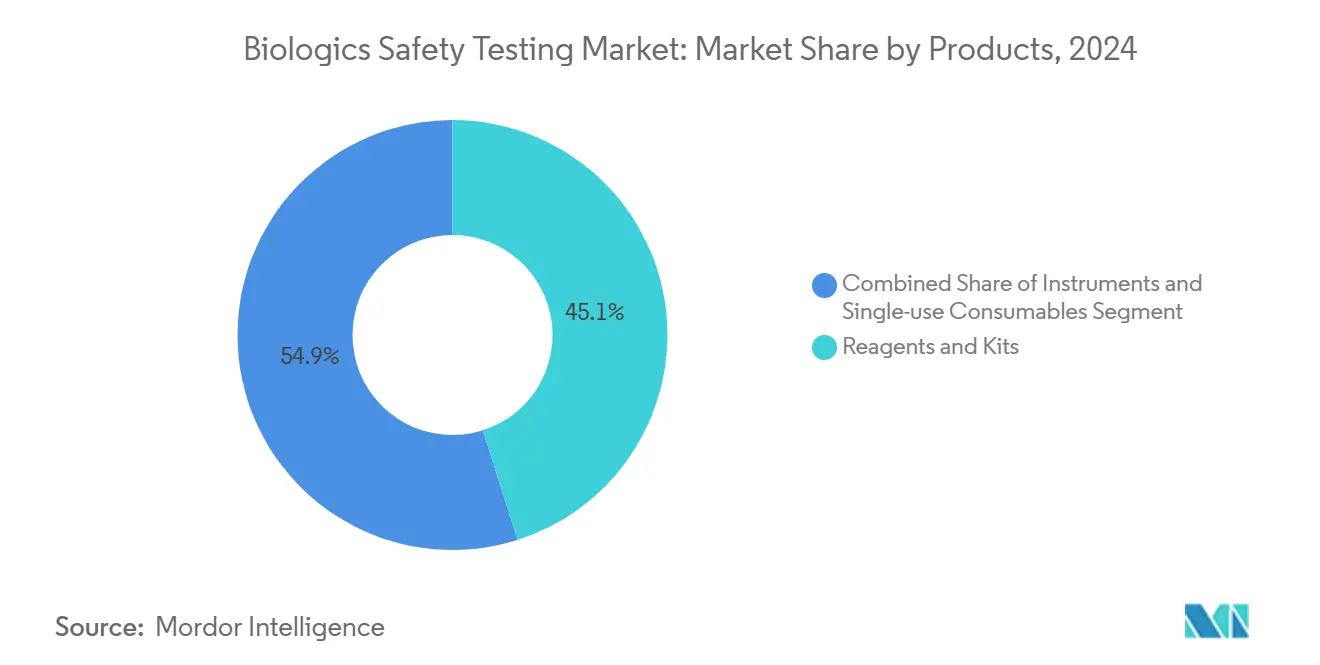
- Por producto y servicio, los reactivos y kits lideraron con una participación de ingresos del 45,12% en 2024; los instrumentos están preparados para registrar la TCAC más rápida del 12,12% hasta 2030.
- Por tipo de prueba, las pruebas de esterilidad mantuvieron el 32,69% de la participación del mercado de pruebas de seguridad biológica en 2024, mientras que la detección de micoplasma se proyecta expandir a una TCAC del 11,71%.
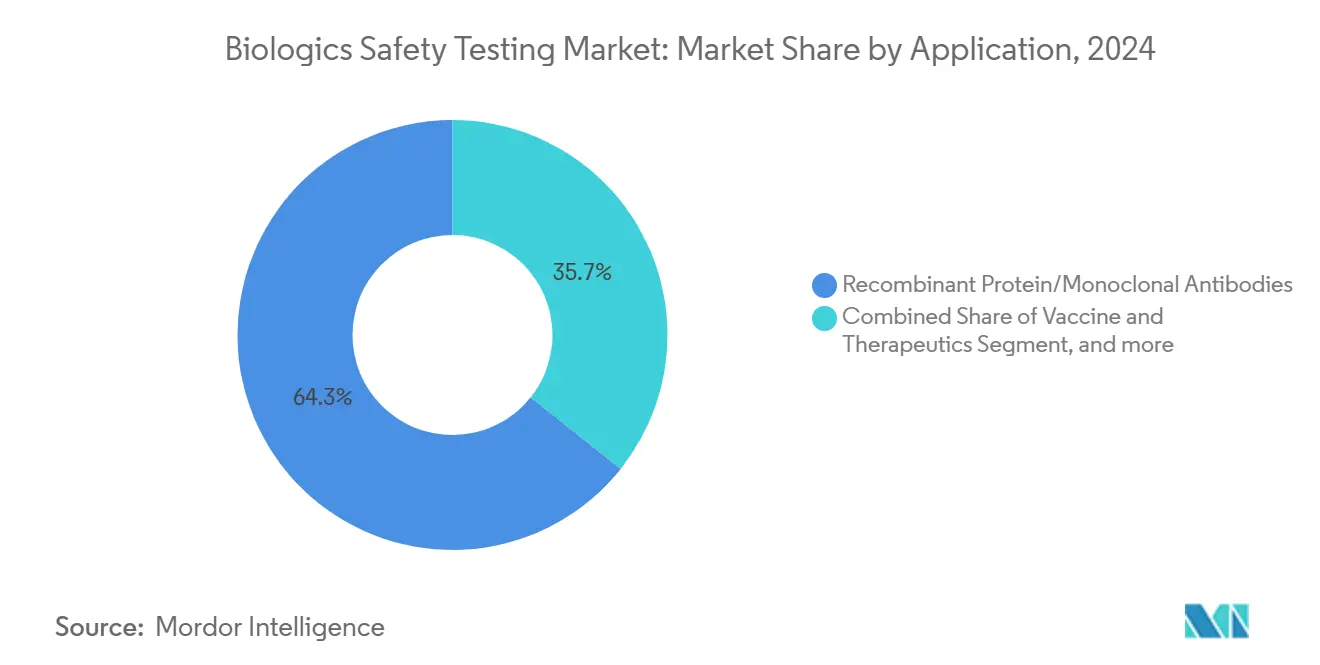
- Por aplicación, las proteínas recombinantes y anticuerpos monoclonales representaron el 64,28% del tamaño del mercado de pruebas de seguridad biológica en 2024 y continúan creciendo a una TCAC del 11,98%.
- Por usuario final, las empresas farmacéuticas y biotecnológicas representaron el 52,38% de los ingresos en 2024, mientras que las CDMO registraron la TCAC más alta del 13,99% hasta 2030.
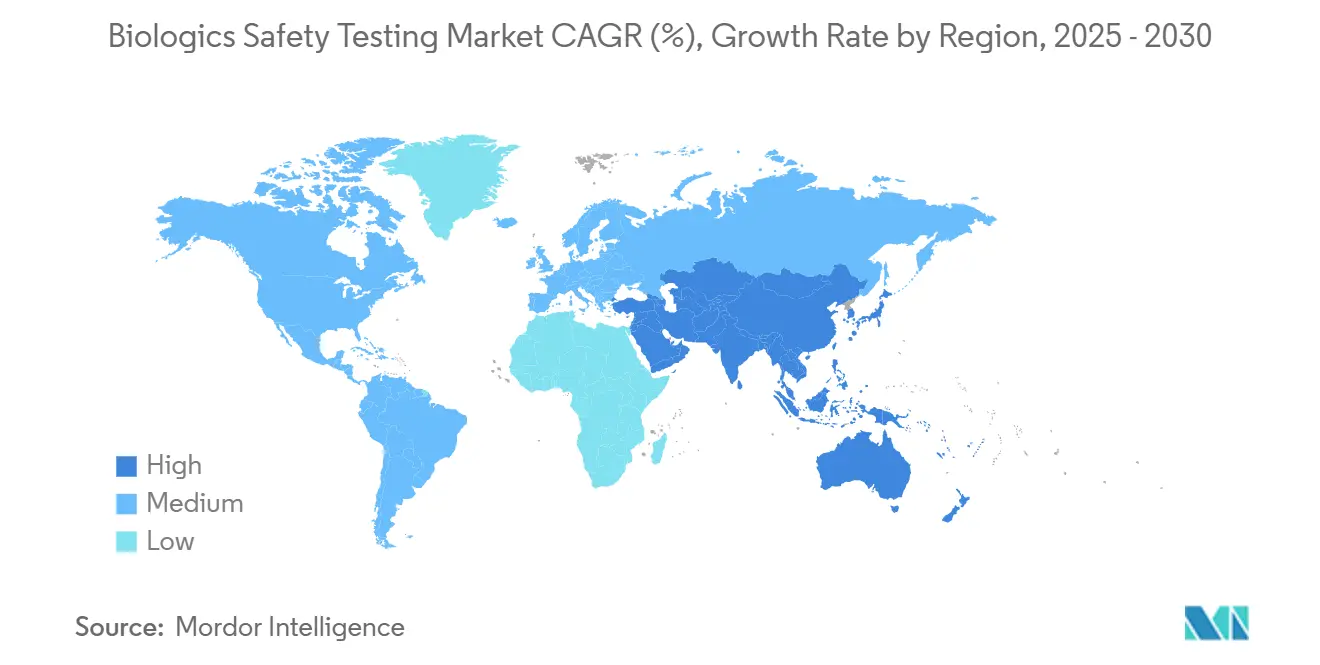
- Por geografía, América del Norte mantuvo el 46,25% de los ingresos en 2024; Asia-Pacífico es la región de crecimiento más rápido con una TCAC del 17,24% hasta 2030.
Tendencias y Perspectivas del Mercado Global de Pruebas de Seguridad Biológica
Análisis de Impacto de Motores
| Motor | (~) % de Impacto en Pronóstico de TCAC | Relevancia Geográfica | Cronograma de Impacto |
|---|---|---|---|
| Crecimiento en el pipeline global farmacéutico-biotecnológico y financiación de capital de riesgo | +2.1% | Global, con concentración en América del Norte y UE | Mediano plazo (2-4 años) |
| Escalamiento de la manufactura de ATMP | +2.8% | Global, liderado por América del Norte, expandiéndose a UE y APAC | Largo plazo (≥ 4 años) |
| Endurecimiento regulatorio en contaminación viral y micoplásmica | +1.9% | Global, armonizado entre jurisdicciones FDA, EMA, PMDA | Corto plazo (≤ 2 años) |
| Aumento de subcontratación a CDMO con base en Asia para QC rentable | +2.4% | Núcleo APAC, con efectos secundarios en cadenas de suministro globales | Mediano plazo (2-4 años) |
| Modelado de bioseguridad in-silico habilitado por IA | +1.2% | Adopción temprana en América del Norte y UE, APAC siguiendo | Largo plazo (≥ 4 años) |
| Programas de preparación para bioamenazas (BARDA, EU-HERA) | +1.1% | América del Norte y UE, con asociaciones estratégicas globalmente | Corto plazo (≤ 2 años) |
| Fuente: Mordor Intelligence | |||
Crecimiento en el Pipeline Global Farmacéutico-Biotecnológico y Financiación de Capital de Riesgo
El flujo de acuerdos en oncología, inmunología y terapia génica está estableciendo máximos históricos. Los tamaños de ronda más grandes financian conjuntos de datos preclínicos más ricos, que a su vez requieren paneles de pruebas de bioseguridad extendidos. Varias start-ups, como Aclid, recaudan capital semilla destinado a plataformas de detección de síntesis de ADN que reducen el riesgo de contaminación, empujando volúmenes hacia empresas de pruebas por contrato. La expansión del pipeline beneficia particularmente a las organizaciones de pruebas por contrato, ya que las empresas farmacéuticas subcontratan cada vez más las pruebas de seguridad a proveedores especializados en lugar de mantener capacidades internas.
Escalamiento de la Manufactura de Productos Medicinales de Terapia Avanzada (ATMP)
Las actualizaciones de orientación de la Agencia Europea de Medicamentos en 2024 y los borradores paralelos de la FDA están atrayendo a los productores de ATMP hacia ensayos expandidos de virus adventicios y autenticación de líneas celulares.[1]U.S. Food and Drug Administration, "Q5A(R2) Viral Safety Evaluation of Biotechnology Products," fda.gov La adquisición de sitio de USD 1,2 mil millones de Lonza en Vacaville ejemplifica la intensidad de capital necesaria para albergar tales suites de QC de alto grado.[2]Lonza Group AG, "Lonza Completes Acquisition of Vacaville Facility," lonza.com Los requisitos únicos de prueba para ATMP, incluyendo detección de virus adventicios y caracterización celular, crean segmentos de mercado especializados con márgenes más altos y barreras técnicas de entrada.
Endurecimiento Regulatorio en Contaminación Viral y Micoplásmica
La revisión de seguridad viral Q5A(R2) de la FDA ahora reconoce la secuenciación de próxima generación y los reactivos de Factor C recombinante, demandando pruebas simultáneas heredadas y alternativas durante períodos de transición. La farmacopea de Europa adoptó rFC para límites de endotoxina en el capítulo 2.6.32, cementando la convergencia global.[3]bioMérieux, "ENDONEXT Recombinant Factor C Assays," biomerieux.com El endurecimiento regulatorio impacta particularmente la detección de micoplasma, donde los métodos de cultivo tradicionales se complementan con técnicas moleculares que ofrecen detección más rápida y sensible. Estos requisitos mejorados impulsan el crecimiento del volumen de pruebas mientras simultáneamente impulsan la innovación tecnológica en metodologías de detección.
Aumento de Subcontratación a CDMO con Base en Asia para Servicios de QC Rentables
Las instalaciones chinas y singapurenses atraen patrocinadores multinacionales al reducir los costos de QC hasta un 60% mientras pasan auditorías regulares de FDA y EMA. Los proveedores occidentales responden con actualizaciones de capacidad doméstica, como la expansión de pruebas de biológicos de SGS en 2024 en Nueva Jersey. El cambio geográfico crea dependencias de cadena de suministro que las empresas farmacéuticas deben manejar cuidadosamente, particularmente dados los riesgos geopolíticos potenciales y las implicaciones de la Ley BIOSECURE para proveedores de servicios chinos. Las Organizaciones de Desarrollo y Manufactura por Contrato representan el segmento de usuario final de crecimiento más rápido con una TCAC del 13,99%, reflejando esta aceleración de subcontratación y la sofisticación creciente de las capacidades de prueba asiáticas.
Análisis de Impacto de Restricciones
| Restricción | (~) % de Impacto en Pronóstico de TCAC | Relevancia Geográfica | Cronograma de Impacto |
|---|---|---|---|
| Ciclos de validación largos para métodos rápidos-micro novedosos | -0.9% | Global, particularmente agudo en mercados regulados | Mediano plazo (2-4 años) |
| Escasez de personal calificado en bioseguridad y altos costos de entrenamiento | -0.6% | Núcleo APAC, expandiéndose a MEA y América Latina | Largo plazo (≥ 4 años) |
| Presión de precios de gran farmacéutica impulsando compresión de márgenes para CRO | -1.1% | Global, concentrado en América del Norte y UE | Corto plazo (≤ 2 años) |
| Fragilidad de cadena de suministro para reactivos de un solo uso (HEPA, LAL) | -0.8% | Global, con impactos agudos en manufactura APAC | Mediano plazo (2-4 años) |
| Fuente: Mordor Intelligence | |||
Ciclos de Validación Largos para Métodos Rápidos-Micro Novedosos
A pesar del aliento de la FDA bajo su marco de Tecnología Analítica de Proceso, la validación global aún demanda 18-24 meses de pruebas lado a lado contra métodos compendiales. Proveedores como Rapid Micro Biosystems demuestran lecturas de esterilidad de 1 a 3 días, sin embargo, los patrocinadores mantienen ensayos heredados paralelos hasta que se demuestre comodidad regulatoria.
Escasez de Personal Calificado en Bioseguridad y Altos Costos de Entrenamiento
Las brechas de competencia se amplían mientras la secuenciación de próxima generación y los análisis de IA entran en el QC mainstream. Los programas de certificación exceden USD 50.000 por científico, y la rotación se mantiene en 20% anualmente en mercados clave. La Red Europea para Enfermedades Altamente Infecciosas pide currículos armonizados para estabilizar la calidad de la fuerza laboral.
Análisis de Segmentos
Por Producto y Servicio: Los Reactivos Mantienen el Núcleo de Ingresos Mientras los Instrumentos se Aceleran
Los reactivos y kits capturaron el 45,12% de los ingresos en 2024, reflejando su arrastre consumible a medida que los volúmenes de prueba se expanden a través de inyectables estériles y lotes de liberación de ATMP. El tamaño del mercado de pruebas de seguridad biológica atribuido a reactivos crece en tándem con la frecuencia elevada de detección de contaminación. Los filtros de un solo uso y viales de endotoxina de Factor C recombinante dominan las órdenes de compra, aunque las eliminaciones graduales de filtros PVDF impulsadas por PFAS están estimulando rediseños. Las ventas de instrumentos avanzan a una TCAC del 12,12%, impulsadas por sistemas automatizados de lectura de placas, análisis ddPCR, y cámaras de incubación en tiempo real. Los vendedores integran módulos de IA que marcan anomalías y previenen falsos positivos, reduciendo investigaciones de desviación. Los ingresos de servicios suben mientras los patrocinadores farmacéuticos subcontratan esterilidad, endotoxina, y autenticación de líneas celulares a laboratorios especialistas, usando contratos agrupados que incluyen logística de muestras y auditoría de integridad de datos. Los pipelines crecientes de ATMP inclinan aún más el gasto hacia paneles de virus-adventicios personalizados, que llevan precios premium.
Nota: Las participaciones de segmento de todos los segmentos individuales disponibles con la compra del informe
Por Tipo de Prueba: La Esterilidad Permanece Fundamental, Micoplasma Corre Adelante
Los ensayos de esterilidad representaron una participación del mercado de pruebas de seguridad biológica del 32,69% en 2024, permaneciendo como un paso crítico de liberación para cada lote parenteral. Los protocolos basados en incubación aún dominan las presentaciones, sin embargo, los sistemas de monitoreo continuo como BACT/ALERT acortan las ventanas de aprobación final. La detección de micoplasma registra la TCAC más alta del 11,71% mientras los kits basados en PCR y flujos de trabajo combinados de secuenciación de ARN reemplazan las esperas de cultivo de 28 días. La convergencia regulatoria alrededor de la aceptación de PCR acelera la adopción, especialmente para intermedios de terapia celular. Las pruebas de endotoxina están migrando al Factor C recombinante, desacoplando el suministro de las escaseces de lisado de cangrejo herradura y mejorando la sostenibilidad. La detección de virus adventicios depende cada vez más de la secuenciación de próxima generación, permitiendo a los patrocinadores ampliar paneles de patógenos sin extender cronogramas.
Por Aplicación: Las Proteínas Recombinantes Dominan los Ingresos, la Terapia Celular y Génica Proporciona el Impulso
Las proteínas recombinantes y anticuerpos monoclonales contribuyeron con el 64,28% a la base de ingresos de 2024 mientras aún se expanden a una TCAC del 11,98%, manteniéndolos como la base del mercado de pruebas de seguridad biológica. Los anticuerpos comerciales de alto volumen demandan QC predecible y de alto rendimiento, impulsando inversión en suites de esterilidad de doble carril que emparejan cultivo heredado con métodos rápidos-micro. Los programas de vacunas permanecen como beneficiarios estables del financiamiento de BARDA y EU-HERA, sin embargo, los desarrolladores de terapia celular y génica entregan el volumen de prueba incremental más empinado por lote debido al escrutinio estricto de vectores virales. Las terapias basadas en sangre agregan complejidad; las tecnologías de inactivación de patógenos adoptadas en Europa aún no son universales en otros lugares, por lo que los laboratorios de QC deben ejecutar múltiples combinaciones de métodos para satisfacer regulaciones divergentes.
Nota: Las participaciones de segmento de todos los segmentos individuales disponibles con la compra del informe
Por Usuario Final: Farmacéutica y Biotecnología Aún las Más Grandes, CDMO se Expanden Más Rápido
Las empresas farmacéuticas y biotecnológicas comandaron el 52,38% del gasto de 2024, ya que retienen competencias de bioseguridad centrales para medicamentos de etapa tardía y comerciales. Sin embargo, la cohorte de CDMO registra una TCAC del 13,99% mientras los patrocinadores conscientes de costos externalizan QC a proveedores de servicios integrados. La adquisición de USD 1,1 mil millones de Avid Bioservices por inversionistas de capital privado subraya el valor estratégico atribuido a huellas de manufactura-y-pruebas agrupadas. Los institutos académicos llenan brechas de ensayo de etapa temprana, a menudo aprovechando plataformas de secuenciación financiadas por subvenciones para caracterizar vectores novedosos. Los fabricantes de dispositivos médicos permanecen como un conjunto de clientes de nicho pero esencial, guiados por las expectativas basadas en riesgo ISO 10993 de la FDA que dependen de evidencia de biocompatibilidad y endotoxina para autorización.
Análisis Geográfico
América del Norte generó el 46,25% de los ingresos globales en 2024, respaldada por el rigor regulatorio de la FDA, adquisiciones de BARDA, y la presencia de productores principales de anticuerpos monoclonales. Los patrocinadores en la región pilotean cada vez más algoritmos de riesgo de contaminación impulsados por IA, propulsando la demanda de incubadores integrados con software. Europa sigue, beneficiándose de clusters de ciencia ATMP a través de Alemania y Reino Unido y de la aceptación farmacopeial de rFC, que acelera cambios de método de endotoxina. El estrés de cadena de suministro sí surge, ya que los consumibles regulados por PFAS enfrentan eliminaciones graduales inminentes que obligan a los laboratorios de la UE a re-calificar alternativas.
Asia-Pacífico registra la TCAC más alta del 17,24% hasta 2030, impulsada por la construcción masiva de CDMO de China, los centros de innovación de terapia celular de Singapur, y las reglas PMDA alineadas con ISO de Japón que facilitan barreras de exportación. Los laboratorios locales aseguran inspecciones multi-regionales de la FDA, validando confiabilidad a puntos de costo más bajos. Aún así, las tensiones geopolíticas y la Ley BIOSECURE pendiente introducen incertidumbre, empujando a algunos patrocinadores a dividir la colocación de QC entre sitios asiáticos y domésticos para redundancia.
Medio Oriente y África y América del Sur permanecen incipientes pero estratégicas. Los institutos nacionales de vacunas en Brasil y Arabia Saudita invierten en suites de esterilidad y micoplasma de grado GMP, respaldados por subvenciones de seguridad sanitaria del Banco Mundial. Los grupos limitados de personal calificado y el suministro de energía intermitente limitan el ritmo, sin embargo, los compromisos a largo plazo con la autonomía de manufactura regional sostienen la demanda incremental de QC.
Panorama Competitivo
La intensidad competitiva es moderada. Charles River Laboratories, Lonza, y Thermo Fisher Scientific anclan el extremo alto, aprovechando la familiaridad regulatoria global y portafolios de servicio completo. Despliegan M&A para absorber innovadores de pruebas rápidas de nicho; la compra de Vacaville de Lonza refuerza la capacidad de anticuerpos a gran escala y suites de bioseguridad co-ubicadas. Mientras tanto, las CDMO asiáticas como WuXi Advanced Therapies comercializan ahorros de costos del 40%-60% para ensayos de esterilidad y vector viral, capturando contratos de biotecnología pequeña y mediana. Los rivales occidentales responden con actualizaciones de automatización doméstica y certificaciones de integridad de datos que justifican precios premium.
La tecnología reemplaza al precio como diferenciador. Los reactivos de Factor C recombinante (rFC) abren el segmento de endotoxina a nuevos proveedores, mientras los vendedores de secuenciación de próxima generación se asocian con laboratorios de QC para insertar sus pipelines en presentaciones regulatorias. La predicción de riesgo habilitada por IA invita a participantes de software que colaboran con OEM de incubadores para incorporar análisis a nivel de equipo. La sostenibilidad es un campo de batalla en ciernes; los proveedores ofrecen filtración de un solo uso libre de PFAS y kits de endotoxina libres de LAL para alinearse con reglas ambientales pendientes.
Las oportunidades de espacio en blanco persisten en modelos de contaminación específicos de ATMP y paneles rápidos de virus adventicios. Los líderes del mercado invierten en acuerdos de desarrollo conjunto con centros académicos de terapia génica, asegurando pipelines de acceso temprano que posteriormente alimentan contratos comerciales. La fragmentación es más pronunciada entre laboratorios regionales de solo prueba que sirven a fabricantes de genéricos locales; es probable la consolidación mientras los requisitos de capital se intensifican.
Líderes de la Industria de Pruebas de Seguridad Biológica
-
Eurofins Scientific
-
Merck KGaA
-
Promega Corporation
-
Thermo Fisher Scientific
-
Lonza Group
- *Nota aclaratoria: los principales jugadores no se ordenaron de un modo en especial
Desarrollos Recientes de la Industria
- Febrero 2025: La FDA finalizó la orientación sobre el Programa de Designación de Tecnologías de Manufactura Avanzada, suavizando la adopción de plataformas de automatización de QC.
- Noviembre 2024: Avid Bioservices entró en una fusión de USD 1,1 mil millones con GHO Capital Partners y Ampersand Capital Partners, destacando la consolidación de servicios de QC.
- Octubre 2024: Lonza completó la adquisición de USD 1,2 mil millones del sitio de Genentech en Vacaville, expandiendo la capacidad de biológicos e infraestructura de QC co-ubicada.
- Octubre 2024: Bio-Rad lanzó el Kit Vericheck ddPCR para evaluación precisa de vector AAV, mejorando la precisión de QC de terapia génica.
- Octubre 2024: Lonza extendió una asociación para suministrar conjugados anticuerpo-medicamento, incluyendo una nueva suite de bioconjugación en Visp, Suiza, operativa en 2027
Alcance del Informe del Mercado Global de Pruebas de Seguridad Biológica
Las pruebas de seguridad biológica se refieren a los procedimientos de prueba que se llevan a cabo para asegurar la no-contaminación de biofarmacéuticos y vacunas y para cumplir con regulaciones respecto a lo mismo. Esto incluye varios tipos de pruebas de esterilidad, autenticación de líneas celulares y pruebas de caracterización, pruebas de carga biológica, pruebas de endotoxina, pruebas de detección de agentes adventicios, y pruebas de detección de contaminación de huésped residual, entre otras. El mercado de Pruebas de Seguridad Biológica está segmentado por Producto (Reactivos y Kits, Instrumentos, Otros Productos), por Aplicación (Vacunas y Terapéuticos, Terapia Celular y Génica, Terapia de Sangre y Basada en Sangre, Otras Aplicaciones), por Prueba (Pruebas de Esterilidad, Pruebas de Carga Biológica, Pruebas de Endotoxina, Otras Pruebas), y Geografía (América del Norte, Europa, Asia-Pacífico, Medio Oriente y África, América del Sur). El informe de mercado también cubre los tamaños de mercado estimados y tendencias para 17 países diferentes a través de regiones principales, globalmente. El informe ofrece el valor (en millones USD) para los segmentos anteriores.
| Productos | Reactivos y Kits |
| Instrumentos | |
| Consumibles de Un Solo Uso | |
| Servicios | Servicios de Pruebas de Esterilidad |
| Servicios de Pruebas de Endotoxina y Pirógeno | |
| Autenticación y Caracterización de Líneas Celulares |
| Pruebas de Esterilidad |
| Pruebas de Carga Biológica |
| Pruebas de Endotoxina/LAL |
| Detección de Micoplasma |
| Detección de Virus Adventicios |
| Proteína Recombinante/Anticuerpos Monoclonales |
| Vacunas y Terapéuticos |
| Terapia Celular y Génica |
| Terapia de Sangre y Basada en Sangre |
| Otra Aplicación |
| Empresas Biofarmacéuticas y Biotecnológicas |
| Organizaciones de Desarrollo y Manufactura por Contrato |
| Institutos Académicos y de Investigación |
| Fabricantes de Dispositivos Médicos |
| América del Norte | Estados Unidos |
| Canadá | |
| México | |
| Europa | Alemania |
| Reino Unido | |
| Francia | |
| Italia | |
| España | |
| Resto de Europa | |
| Asia-Pacífico | China |
| Japón | |
| India | |
| Australia | |
| Corea del Sur | |
| Resto de Asia-Pacífico | |
| Medio Oriente y África | CCG |
| Sudáfrica | |
| Resto de Medio Oriente y África | |
| América del Sur | Brasil |
| Argentina | |
| Resto de América del Sur |
| Por Producto y Servicio | Productos | Reactivos y Kits |
| Instrumentos | ||
| Consumibles de Un Solo Uso | ||
| Servicios | Servicios de Pruebas de Esterilidad | |
| Servicios de Pruebas de Endotoxina y Pirógeno | ||
| Autenticación y Caracterización de Líneas Celulares | ||
| Por Tipo de Prueba | Pruebas de Esterilidad | |
| Pruebas de Carga Biológica | ||
| Pruebas de Endotoxina/LAL | ||
| Detección de Micoplasma | ||
| Detección de Virus Adventicios | ||
| Por Aplicación | Proteína Recombinante/Anticuerpos Monoclonales | |
| Vacunas y Terapéuticos | ||
| Terapia Celular y Génica | ||
| Terapia de Sangre y Basada en Sangre | ||
| Otra Aplicación | ||
| Por Usuario Final | Empresas Biofarmacéuticas y Biotecnológicas | |
| Organizaciones de Desarrollo y Manufactura por Contrato | ||
| Institutos Académicos y de Investigación | ||
| Fabricantes de Dispositivos Médicos | ||
| Por Geografía | América del Norte | Estados Unidos |
| Canadá | ||
| México | ||
| Europa | Alemania | |
| Reino Unido | ||
| Francia | ||
| Italia | ||
| España | ||
| Resto de Europa | ||
| Asia-Pacífico | China | |
| Japón | ||
| India | ||
| Australia | ||
| Corea del Sur | ||
| Resto de Asia-Pacífico | ||
| Medio Oriente y África | CCG | |
| Sudáfrica | ||
| Resto de Medio Oriente y África | ||
| América del Sur | Brasil | |
| Argentina | ||
| Resto de América del Sur | ||
Preguntas Clave Respondidas en el Informe
¿Cuál es el tamaño actual del mercado de pruebas de seguridad biológica?
El mercado está valorado en USD 4,54 mil millones en 2025 y se proyecta alcanzar USD 7,88 mil millones en 2030.
¿Qué región crece más rápido en pruebas de seguridad biológica?
Asia-Pacífico lidera con una TCAC del 17,24%, impulsada por la construcción de CDMO de China y la expansión del alineamiento regulatorio.
¿Por qué las proteínas recombinantes son significativas para la demanda de pruebas de bioseguridad?
Las proteínas recombinantes y anticuerpos monoclonales mantienen el 64,28% de los ingresos en 2024, requiriendo ensayos de esterilidad y endotoxina de alto volumen para mantener el suministro global.
¿Cómo está la IA influenciando los flujos de trabajo de pruebas de seguridad biológica?
El modelado in-silico habilitado por IA predice riesgos de contaminación, apoya la liberación en tiempo real, y puede reducir fallas de lote, especialmente en líneas de producción de vectores virales.
¿Qué está reemplazando las pruebas tradicionales de endotoxina LAL?
Los reactivos de Factor C recombinante obtienen aceptación regulatoria, eliminan la dependencia de cangrejo herradura, y proporcionan 100% especificidad de endotoxina.
¿Qué grupo de usuarios finales se está expandiendo más rápido?
Las Organizaciones de Desarrollo y Manufactura por Contrato registran una TCAC del 13,99% mientras los patrocinadores subcontratan QC a proveedores de servicios integrados.
Última actualización de la página el: